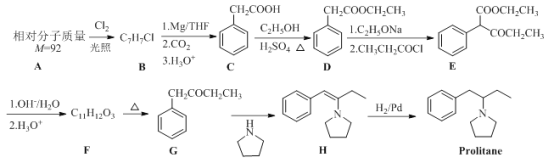
题目内容
【题目】(1)已知常温时,0.1mol/L醋酸在水中有0.1%发生电离,则该溶液的pH=_____,醋酸的电离平衡常数Ka=______。
(2)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如图所示:
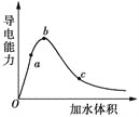
①a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是___。
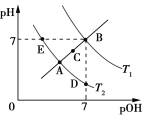
②a、c两点对应的溶液分别吸收氨气,若两溶液最终pH均为7(25℃时),则a点溶液中的c(CH3COO-)_______c点溶液中的c(NH4+)。(填“<”、“>”或“=”)
(3)25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | NH3·H2O | H2CO3 | HCN |
电离平衡常数 | 1.7×10-5 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K=5.0×10-10 |
请回答下列问题:
①H2CO3的第二级电离平衡常数的表达式Ka2=_______。
②25℃时,向0.1molL-1的氨水中缓缓通入CO2气体的过程中(忽略溶液体积的变化),下列表达式的数值变小的是___。
A.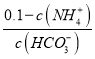 B.
B.![]() C.
C.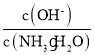 D.
D.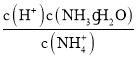
③向NaCN溶液中通入少量CO2气体,发生反应的离子方程式为___。
【答案】4 10-7 c>b>a > 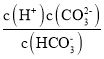 AC CN--+CO2+H2O=HCN-+HCO3-
AC CN--+CO2+H2O=HCN-+HCO3-
【解析】
(1)依据弱电解质的电离度分析计算pH,计算平衡浓度结合电离平衡常数概念计算平衡常数;
(2)①溶液体积越大,醋酸电离程度越大;
②25℃时,铵盐溶液pH=7,则溶液中存在c(OH-)=c(H+),根据电荷守恒得c(CH3COO-)=c(NH4+),所以两点溶液中c(CH3COO-)越大则该点溶液中的c(NH4+)越大;
(3)①根据弱酸的电离平衡常数的含义书写H2CO3的第二级电离平衡常数的表达式Ka2;
弱酸的电离平衡常数越大,其酸性越强,其酸根的水解程度越弱;
②25℃时,向0.1 molL-1的氨水中缓缓少量CO2气体,二者反应生成碳酸铵,溶液中存在电荷守恒和物料守恒;
③次氯酸酸性大于碳酸氢根离子,反应生成碳酸氢钠和次氯酸。
(1)已知常温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,依据电离度=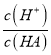
可知,c(H+)=0.1mol/L×0.1%=1×10-4mol/L,则溶液的pH=-lg(H+)=4;依据弱电解质的电离平衡HA![]() H++A-,Ka=
H++A-,Ka=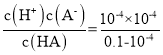 ≈1×10-7;
≈1×10-7;
(2)①溶液体积越大,醋酸电离程度越大,根据图知,溶液体积:a<b<c,则醋酸电离程度:c>b>a;
②25℃时,铵盐溶液pH=7,则溶液中存在c(OH-)=c(H+),根据电荷守恒得c(CH3COO-)=c(NH4+),所以两点溶液中c(CH3COO-)越大则该点溶液中的c(NH4+)越大,由于溶液中c(CH3COO-):a>c,则c(NH4+):a>c;
(3)①H2CO3是二元弱酸,其第二步电离平衡为HCO3-![]() H++CO32-,由于电离平衡常数为电解质达到电离平衡时,电解质电离产生的离子浓度的乘积与未电离的电解质浓度的比,所以其平衡常数表达式为Ka2=
H++CO32-,由于电离平衡常数为电解质达到电离平衡时,电解质电离产生的离子浓度的乘积与未电离的电解质浓度的比,所以其平衡常数表达式为Ka2=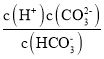 。
。
②随着二氧化碳的通入生成的碳酸铵逐渐增多,溶液中c(NH4+)增大,则c(NH3H2O)=0.1-c c(NH4+)减小、溶液中c(HCO3-)增大,则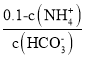 减小,A正确;
减小,A正确;
B.随着二氧化碳的通入生成的碳酸铵逐渐增多,溶液碱性减弱,则c(H+)增大、c(OH-)减小,则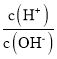 增大,B错误;
增大,B错误;
C.温度不变电离平衡常数不变,随着二氧化碳的通入,溶液中c(NH4+)增大,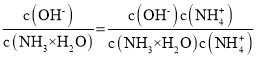 =
=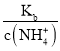 减小,C正确;
减小,C正确;
D.温度不变离子积常数及电离平衡常数不变,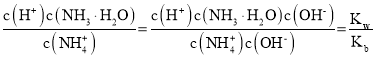 不变,D错误;
不变,D错误;
故合理选项是AC;
③根据电离平衡常数可知酸性:HClO>HCO3-,向次氯酸钠溶液中通入少量二氧化碳,反应生成碳酸氢根离子,该反应的离子方程式为:CN--+CO2+H2O=HCN-+HCO3-。

 步步高达标卷系列答案
步步高达标卷系列答案