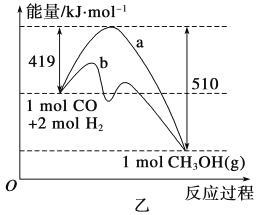
题目内容
【题目】常温下,向10mL0.1mol·L-1H2A溶液中逐滴加入0.1mol·L-1NaOH溶液。有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。根据图示分析判断,下列微粒浓度大小关系正确的是

A. 当v=0时,c(H+)=c(OH-)+c(HA-)+c(A2-)
B. 当v=10时,c(Na+)=c(H2A)+c(HA-)+c(A2-)
C. 当v=20时,c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+)
D. 当pH=7时,c(Na+)>c(HA-)+ c(A2-)
【答案】BD
【解析】【解析】v=0时,研究对象就是H2A溶液,根据离子电荷守恒,c(H+)=c(OH-)+c(HA-)+2c(A2-),A错误。v=10时,反应恰好生成NaHA,Na原子与A原子(或原子团)数目相等,而A在溶液中有三种形式,则c(Na+)=c(H2A)+c(HA-)+c(A2-),B正确。未加入NaOH时H2A物质的量接近1×10-3mol,溶液中HA-也很少,说明H2A为弱酸,v=20时,反应恰好生成Na2A,所以A2-在溶液中会水解生成OH-、HA-、H2A,但是由于水解程度一般都比较小,所以未水解的A2-远大于水解生成的HA-,且水解生成的H2A更少,即c(A2-) >c(HA-)>c(H2A);A2-水解生成的HA-与OH-的量相等,但是在此基础上HA-因进一步水解会有所减少,而OH- 增加,此外,H2O电离也有少量OH-生成,则c(HA-)>c(OH-) ,所以c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+),C错误。常温下pH=7为中性溶液,该混合中性的溶液中上述各种离子都同时存在,根据电荷守恒,则c(Na+)+c(H+)=2c(A2-)+c(HA-)+c(OH-),因为c(H+)=c(OH-),所以c(Na+)=2c(A2-)+c(HA-),则c(Na+)>c(A2-)+c(HA-),D正确。正确答案选BD。

 名校课堂系列答案
名校课堂系列答案【题目】一定温度下,向3个初始体积均为1.0 L的密闭容器中按下表所示投料,发生反应N2(g)+3H2(g)![]() 2NH3(g) △H<0达到平衡,下列说法错误的是
2NH3(g) △H<0达到平衡,下列说法错误的是
容器编号 | 容器类型 | 起始物质的量/mol | 反应物的转化率 | 平衡时NH3的物质的量/mol | ||
N2 | H2 | NH3 | ||||
Ⅰ | 恒温恒容 | 1 | 3 | 0 | α1 | 1.2 |
Ⅱ | 绝热恒容 | 1 | 3 | 0 | α2 | a |
Ⅲ | 恒温恒压 | 2 | 6 | 0 | α3 | b |
A. 达到平衡时,α1>α2
B. 平衡时NH3的物质的量b<2.4
C. 达到平衡时,容器Ⅱ中的反应速率比容器Ⅰ中的大
D. 保持温度不变,向容器Ⅰ中再充入0.1mol N2、0.2mol H2、0.2 mol NH3,平衡向正反应方向移动