题目内容
7.X、Y、Z、L、M五种元素的原子序数依次增大,X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素回答下列问题:
(1)Z、X两元素按原子数目比1:3和2:4构成分子A和B,A的电子式为
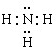 ,B的结构式为
,B的结构式为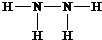 .
.(2)硒(Se) 是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为34,其最高价氧化物对应的水化物化学式为H2SeO4;Z的氢化物与氯化氢相遇时的现象是有白烟生成.
(3)同主族元素形成的同一类化合物往往在结构和性质上很相似.化合物PH4I是一种白色晶体,则对PH4I的叙述不正确的是A
A.它是一种共价化合物
B.加热时PH4I可以分解,而且有颜色变化
C.它可以跟NaOH反应
D.它可由PH3和HI化合而成.
分析 根据M是地壳中含量最高的金属元素及地壳中元素的含量可知M为铝元素,再由X、Y、Z、L是组成蛋白质的基础元素及元素的原子序数依次增大,则X、Y、Z、L分别为氢、碳、氮、氧,
(1)根据原子数写化学式,再由最外层电子数来分析电子式和结构式;
(2)根据最外层电子数分析最高化合价,然后书写最高价氧化物对应的水化物化学式;根据氨气与氯化氢的反应现象解答;
(3)同主族元素所形成的同一类型的化合物,其结构和性质往往相似,则PH4I与NH4Cl性质相似,根据NH4Cl的性质判断.
解答 解:根据M是地壳中含量最高的金属元素及地壳中元素的含量可知M为铝元素,再由X、Y、Z、L是组成蛋白质的基础元素及元素的原子序数依次增大,则X、Y、Z、L分别为氢、碳、氮、氧,
(1)因Z、X两元素分别为N、H元素,原子数目比l:3和2:4构成分子A和B分别为NH3、N2H4,氮原子在分子中满足最外层8电子结构,
故答案为: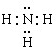 ;
; ;
;
(2)L为氧元素,Se与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为8+8+18=34,其最外层电子数为6,则最高化合价为6,最高价氧化物对应的水化物化学式为H2SeO4;Z为N元素,其氢化物为氨气,氨气与氯化氢相遇会有白烟生成,
故答案为:34;H2SeO4;有白烟生成;
(3)同主族元素所形成的同一类型的化合物,其结构和性质往往相似,则PH4I与NH4Cl性质相似,则
A.PH4I与NH4Cl性质相似,都属于离子化合物,故A错误;
B.PH4I与NH4Cl性质相似,具有热不稳定性,加热易分解,分解产物为PH3和HI,HI受热分解得到氢气和紫色的碘蒸气,故B正确;
C、由NH4Cl的性质判断,该化合物能与强碱发生反应生成PH3,故C正确;
D.根据NH4Cl的性质判断,PH3与HI化合可生成PH4I,故D正确;
故答案为:A.
点评 本题考查位置、结构与性质关系的应用,题目难度中等,熟练掌握原子结构与元素周期表、元素周期律的关系为解答关键,明确常见化学用语的概念及表示方法,试题培养了学生灵活应用基础知识的能力.

 阅读快车系列答案
阅读快车系列答案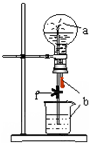 如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是
如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是 | a(干燥气体) | b(液体) | |
| A | NO2 | 水 |
| B | CO2 | 饱和NaHCO3溶液 |
| C | Cl2 | 饱和NaCl水溶液 |
| D | NH3 | NaNO3稀溶液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 3.18g | B. | 2.12g | C. | 4.22g | D. | 5.28g |
| A. | NO是一种红棕色的气体 | |
| B. | 常温常压下NO不能与空气中的氧气直接化合 | |
| C. | 含等质量的氧元素的NO和CO的物质的量相等 | |
| D. | NO易溶于水,不能用排水法收集 |
| A. | 称取7.6g硫酸铜,加入500 mL的水 | B. | 称取8.0g硫酸铜,配成500mL溶液 | ||
| C. | 称取12.0g胆矾,配成500mL溶液 | D. | 称取12.5g胆矾,加入500mL水 |
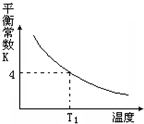 T℃时,将1molX和2molY投入2L的密闭容器中,发生反应X(g)+Y(g)?2Z(g),X、Y的量随时间变化如下表,该反应的平衡常数随温度的变化如下图.则下列判断正确的是( )
T℃时,将1molX和2molY投入2L的密闭容器中,发生反应X(g)+Y(g)?2Z(g),X、Y的量随时间变化如下表,该反应的平衡常数随温度的变化如下图.则下列判断正确的是( )| 0 | 1 | 2 | 3 | 4 | 5 | 6 | |
| X | 1 | 0.80 | 0.66 | 0.58 | 0.52 | 0.50 | 0.50 |
| Y | 2 | 1.80 | 1.66 | … | … | … | … |
| A. | 前5min用Z表示的平均反应速率为0.2 mol/(L•min) | |
| B. | 该反应的正反应是吸热反应,且T1>T | |
| C. | 若温度为T1时,以同样的起始量反应,达到平衡时X的转化率约为66.7% | |
| D. | 在T℃时,以1molX、2molY和1molZ充入上述容器中,达到平衡时,X的转化率仍为50% |
| A. | Li的原子结构示意图为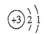 | B. | 原子半径:P>S | ||
| C. | 酸性:H3PO4<H2SO4 | D. | Li、Ge、P、S都属于短周期元素 |
 .
.