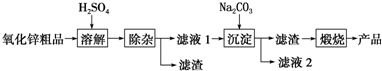
题目内容
11.下列溶液中离子一定能够大量共存的是( )| A. | 使甲基橙变红的溶液中:NH4+、NO3-、Na+、SO42- | |
| B. | 无色透明的溶液中:Ba2+、H+、MnO4-、Br- | |
| C. | 能使淀粉碘化钾试纸显蓝色的溶液中:K+、SO42-、S2-、SO32- | |
| D. | 加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- |
分析 A.使甲基橙变红的溶液显示酸性,溶液中存在大量氢离子,四种离子之间不反应,都不与氢离子反应;
B.高锰酸根为有色离子,且酸性条件下高锰酸根离子能够氧化溴离子;
C.能使淀粉碘化钾试纸显蓝色的溶液具有氧化性,能够氧化硫离子、亚硫酸根离子;
D.加入铝粉能产生氢气的溶液中存在大量氢离子或氢氧根离子,亚铁离子能够与氢氧根离子反应,硝酸根离子在酸性条件下与铝反应不会生成氢气.
解答 解:A.使甲基橙变红的溶液中存在大量氢离子,NH4+、NO3-、Na+、SO42-之间不发生反应,都不与氢离子反应,在溶液中能够大量共存,故A正确;
B.H+、MnO4-与Br-之间发生氧化还原反应,且MnO4-为有色离子,在溶液中不能大量共存,故B错误;
C.能使淀粉碘化钾试纸显蓝色,该溶液具有氧化性,能够氧化S2-、SO32-,在溶液中不能大量共存,故C错误;
D.加入铝粉能产生氢气的溶液中为酸性或强碱性溶液,溶液中存在大量氢离子或氢氧根离子,Fe2+与氢氧根离子反应,NO3-在酸性条件下具有强氧化性,能够氧化Fe2+,且与铝反应不会生成氢气,在溶液中一定不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的正误判断,题目难度中等,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
2.制取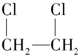 最合理的方法是( )
最合理的方法是( )
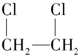 最合理的方法是( )
最合理的方法是( )| A. | CH3CH3与Cl2取代 | B. | CH2═CH2与HCl加成 | ||
| C. | CH2═CH2与Cl2加成 | D. | CH3CH2Cl与Cl2取代 |
19.已知:在273K,101Kpa的条件下,某气体:①质量为m,②相对分子质量为M,③体积为V,④密度为ρ,⑤所含分子数为N(阿伏伽德罗常数为NA),通过以上条件无法求出该气体物质的量的是( )
| A. | ①② | B. | ③ | C. | ⑤ | D. | ②④ |
6.工业上用NaOH溶液吸收制取HNO3的尾气NO和NO2,反应的化学方程如下:NO+NO2+2NaOH═2NaNO2+H2O;2NO2+2NaOH═NaNO2+NaNO3+H2O某次实验中,将40mL的NO和60mL的NO2一起通入足量的NaOH溶液中充分吸收后,剩余气体的体积为( )
| A. | 40mL | B. | 60mL | C. | 20mL | D. | 0mL |
16.已知短周期元素的四种离子A2+、B+、C3-、D-具有相同的电子层结构,则下列叙述中正确的是( )
| A. | 原子序数:D>C>B>A | B. | 原子半径:B>A>C>D | ||
| C. | 离子半径:C3->D->A2+>B+ | D. | 氧化性:A2+>B+,还原性:C3-<D- |
3.工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2.在该反应中( )
| A. | 二氧化硫体现还原性,做还原剂 | |
| B. | 氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 每生成1molNa2S2O3,转移4mol电子 | |
| D. | 相同条件下,每吸收10m3SO2就会放出2.5m3CO2 |
1.下列仪器不能加热的是( )
| A. | 燃烧匙、蒸发皿 | B. | 圆底烧瓶、坩埚 | C. | 量筒、容量瓶 | D. | 试管、锥形瓶 |