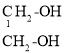��Ŀ����
����Ŀ��W��X��Y��Z��M��RΪ6�ֶ�����Ԫ�ء�Wԭ�ӵĺ˵������������������X+��Ne������ͬ�ĵ��Ӳ�ṹ��Yԭ����Zԭ�ӵ�����������֮����Rԭ�ӵ�������������ȣ�Y��Z��M��R�����ڱ��е����λ����ͼ��ʾ��
Z | M | R | ||
Y |
��1��ZԪ�������ڱ���λ��Ϊ________��
��2��R���ӵĽṹʾ��ͼΪ_________��
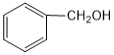
��3��X��M��1:1�γɵĻ������д��ڵĻ�ѧ������Ϊ____________��
��4��Y�������������X������������ˮ������ˮ��Һ�з�����Ӧ�����ӷ���ʽΪ_________________________________��
��5��Y��Z �γ���Է�����Ϊ144�Ļ�������M�ļ��⻯�ﷴӦ�������������Y������������ˮ����÷�Ӧ�Ļ�ѧ����ʽΪ__________________________��
��6��M��R���γ�M2R2���ӣ��÷����и�ԭ�Ӿ��ﵽ8�����ȶ��ṹ����M2R2�ĵ���ʽΪ__________________��
���𰸡��ڶ�������A�� ![]() �Ǽ��Թ��ۼ������Ӽ� Al2O3+2OH=2AlO2+H2O Al4C3+12H2O=4Al(OH)3��+3CH4��
�Ǽ��Թ��ۼ������Ӽ� Al2O3+2OH=2AlO2+H2O Al4C3+12H2O=4Al(OH)3��+3CH4�� ![]()
��������
W��X��Y��Z��M��RΪ6�ֶ�����Ԫ�أ�Wԭ�ӵĺ˵��������������������WΪHԪ�أ�X+��Ne������ͬ�ĵ��Ӳ�ṹ����XΪNa����Y����������Ϊa����Z��Rԭ�������������ֱ�Ϊa+1��a+4����a+a+1=a+4�����a=3����YΪAl��ZΪC��MΪO��RΪF���ݴ˽��
(1)ZΪCԪ�أ�λ�����ڱ��ڶ�������A�壻
(2)R����ΪF�����ӵĽṹʾ��ͼΪ![]() ��
��
(3)XΪNa��MΪO��X��M��1:1�γɵĻ�����ΪNa2O2�����д��ڵĻ�ѧ���зǼ��Թ��ۼ������Ӽ���
(4)Y�����������ΪAl2O3��X������������ˮ����ΪNaOH�����߷�����Ӧ�����ӷ���ʽΪ��Al2O3+2OH=2AlO2+H2O��
(5) YΪAl��ZΪC��Y��Z �γ���Է�����Ϊ144�Ļ�����Ϊ��Al4C3��M�ļ��⻯��Ϊ��H2O��Al4C3��H2O��Ӧ���������CH4��Y������������ˮ����Al(OH)3������ʽΪ��Al4C3+12H2O=4Al(OH)3��+3CH4����
(6) M��R���γ�O2F2���÷����и�ԭ�Ӿ��ﵽ8�����ȶ��ṹ����ԭ��֮���γ�1�Թ��õ��Ӷԣ���ԭ�����ԭ��֮���γ�1�Թ��õ��Ӷԣ���O2F2�ĵ���ʽΪ![]() ��
��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�