题目内容
【题目】常温下,用0.10 mol/LKOH溶液滴定10.00mL 0.10 mol/L某二元弱酸H2R溶液,滴定曲线如图(混合溶液总体积看作混合前两种溶液体积之和),下列关系正确的是
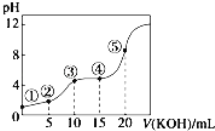
A. 点②所示溶液中:c(K+)+c(H+)=c(HR﹣)+c(R2﹣)+c(OH﹣)
B. 点③所示溶液中:c(K+)>c(HR﹣)>c(H2R)>c(R2﹣)
C. 点④所示溶液中:c(H2R)+c(HR﹣)+c(R2﹣)=0.04 mol.L-1
D. 点⑤所示溶液中:c(H+)=c(HR﹣)+2c(H2R)+c(OH﹣)
【答案】C
【解析】
A.点②为混合溶液,由电荷守恒可知:c(K+)+c(H+)=c(HR-)+2c(R2-)+c(OH-),故A错误; B.点③溶液是等体积等浓度KOH、H2R反应生成的KHR,显酸性,HR-电离大于其水解,所以离子浓度为c(K+)>c(HR-)>c(R2-)>c(H2R),故B错误; C.点④溶液的体积为25mL,由物料守恒可知,c(H2R)+c(HR-)+c(R2-)=![]() =0.04 mol/L,故C正确; D.点⑤用20ml 0.10mol
=0.04 mol/L,故C正确; D.点⑤用20ml 0.10mol![]() L-1KOH溶液滴定10.00mL 0.10 mol
L-1KOH溶液滴定10.00mL 0.10 mol![]() L-1二元弱酸H2R溶液反应生成K2R,根据质子守恒可知:c(H+)+c(HR-)+2c(H2R)=c(OH-),故D错误。
L-1二元弱酸H2R溶液反应生成K2R,根据质子守恒可知:c(H+)+c(HR-)+2c(H2R)=c(OH-),故D错误。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】W、X、Y、Z、M、R为6种短周期元素。W原子的核电荷数等于其周期数,X+与Ne具有相同的电子层结构,Y原子与Z原子的最外层电子数之和与R原子的最外层电子数相等;Y、Z、M、R在周期表中的相对位置如图所示。
Z | M | R | ||
Y |
(1)Z元素在周期表的位置为________。
(2)R离子的结构示意图为_________。
(3)X与M以1:1形成的化合物中存在的化学键类型为____________。
(4)Y的最高价氧化物与X的最高价氧化物的水化物在水溶液中发生反应的离子方程式为_________________________________。
(5)Y与Z 形成相对分子量为144的化合物与M的简单氢化物反应,生成最简单的烃和Y的最高价氧化物的水化物,该反应的化学方程式为__________________________。
(6)M与R可形成M2R2分子,该分子中各原子均达到8电子稳定结构,则M2R2的电子式为__________________。
【题目】“中和滴定”原理在实际生产生活中应用广泛。用I2O5可定量测定CO的含量,该反应原理为5CO+I2O5![]() 5CO2+I2。其实验步骤如下:
5CO2+I2。其实验步骤如下:
①取250 mL(标准状况)含有CO的某气体样品通过盛有足量I2O5的干燥管中在170 ℃下充分反应;
②用水一乙醇液充分溶解产物I2,配制100 mL溶液;
③量取步骤②中溶液25.00 mL于锥形瓶中,然后用0.01 mol·L-1的Na2S2O3标准溶液滴定。消耗标准Na2S2O3溶液的体积如表所示。
第一次 | 第二次 | 第三次 | |
滴定前读数/mL | 2.10 | 2.50 | 1.40 |
滴定后读数/mL | 22.00 | 22.50 | 21.50 |
(1)步骤②中配制100 mL待测溶液需要用到的玻璃仪器的名称是烧杯、量筒、玻璃棒、胶头滴管和____________________。
(2)Na2S2O3标准液应装在__________(填字母)中。

(3)指示剂应选用__________,判断达到滴定终点的现象是____________________________________。
(4)气体样品中CO的体积分数为__________(已知:气体样品中其他成分不与I2O5反应:2Na2S2O3+I2=2NaI+Na2S4O6)
(5)下列操作会造成所测CO的体积分数偏大的是__________(填字母)。
a.滴定终点俯视读数
b.锥形瓶用待测溶液润洗
c.滴定前有气泡,滴定后没有气泡
d.配制100 mL待测溶液时,有少量溅出