题目内容
钢铁是21世纪用途最广的结构材料和功能材料。其成分主要是Fe和少量C。
(1)工业上在炼铁高炉中用CO热还原Fe2O3冶炼铁。写出该反应的化学方程式并用单线桥表示电子转移的方向和数目 。
(2)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图(黑球代表Fe,白球代表Mg)。则铁镁合金的化学式为 。
(3)Fe3+的电子排布式为 ;CH3+微粒的中心原子杂化轨道类型为 ;
(4)向一定量的FeCl3溶液中加入适量KSCN溶液,溶液变红色。该反应体系中存在化学平衡 (用反应式表示);向上述红色溶液中加入Mg(OH)2固体,可观察到溶液红色变浅,有红褐色沉淀析出。试用平衡移动原理解释该现象 。(不考虑SCN—与Mg2+反应)
(1)
(2)FeMg2
(3)1S22S23S23P63d5 SP2
Fe2++3SCN- Fe(SCN-)3 (红色) 由于氢氧化铁的溶解度小于氢氧化镁的溶解度,向上述体系中加入氢氧化镁后,发生沉淀转化:氢氧化镁沉淀转化成氢氧化铁沉淀,消耗了三价铁离子,使Fe2++3SCN-
Fe(SCN-)3 (红色) 由于氢氧化铁的溶解度小于氢氧化镁的溶解度,向上述体系中加入氢氧化镁后,发生沉淀转化:氢氧化镁沉淀转化成氢氧化铁沉淀,消耗了三价铁离子,使Fe2++3SCN- Fe(SCN-)3 平衡向左移动,Fe(SCN-)3 减少。
Fe(SCN-)3 平衡向左移动,Fe(SCN-)3 减少。
解析试题分析:(1)根据元素守恒和质量守恒定律,不难写出相关化学方程式和画出单线桥;(2)利用均摊法,
Fe:8×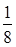 +6×
+6×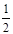 =4;Mg:8;得到铁镁合金化学式:FeMg2;(3)根据能量最低原理和核外电子排布原理,不难写出Fe3+,核外电子排布式;CH3+微粒的中心原子C,含有3δ,孤电子对数:
=4;Mg:8;得到铁镁合金化学式:FeMg2;(3)根据能量最低原理和核外电子排布原理,不难写出Fe3+,核外电子排布式;CH3+微粒的中心原子C,含有3δ,孤电子对数: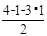 =0,
=0,
价层电子对数为4,杂化轨道类型SP2。(4)存在平衡Fe3++3SCN- Fe(SCN)3,根据勒夏特列原理不
Fe(SCN)3,根据勒夏特列原理不
难判断化学平衡的移动方向。
考点:考查化学平衡的移动、元素原子核外的电子排布等。

用纯净的碳酸钙跟稀盐酸反应制取二氧化碳气体,请回答:
(1)实验过程如右图所示,分析判断: 段化学反应速率最快, 段收集的二氧化碳最多。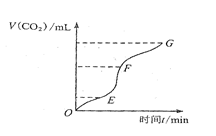
(2)为了减缓上述化学反应的速率,欲向溶液中加入下列物质,你认为可行的是( )
| A.蒸馏水 | B.NaCl固体 | C.NaCl溶液 | D.浓盐酸 |
我国有丰富的天然气资源。以天然气为原料合成尿素的主要步骤如下图所示(图中某些转化步骤及生成物未列出):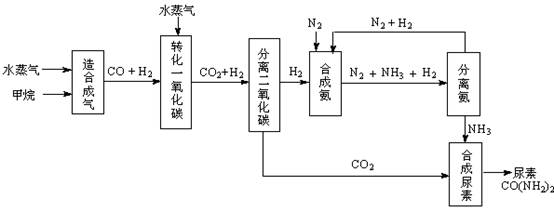
(1)“造合成气”发生的热化学方程式是CH4(g)+H2O(g) 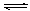 CO(g)+3H2(g);△H>0
CO(g)+3H2(g);△H>0
在恒温恒容的条件下,欲提高CH4的反应速率和转化率,下列措施可行的是 。
A、增大压强 B、升高温度 C、充入He气 D、增大水蒸气浓度
(2)“转化一氧化碳”发生的方程式是H2O(g) +CO(g) 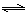 H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
提高氢碳比[ n(H2O)/n(CO)],K值 (填“增大”、“不变”或“减小”);若该反应在400℃时进行,起始通入等物质的量的H2O和CO,反应进行到某一时刻时CO和CO2的浓度比为1∶3,此时v(正) v(逆)(填“>”、“=”或“<”)。
(3)有关合成氨工业的说法中正确的是 。
A、该反应属于人工固氮
B、合成氨工业中使用催化剂能提高反应物的利用率
C、合成氨反应温度控制在500℃左右,目的是使化学平衡向正反应方向移动
D、合成氨工业采用循环操作的主要原因是为了加快反应速率
(4)生产尿素过程中,理论上n(NH3)∶n(CO2)的最佳配比为 ,而实际生产过程中,往往使n(NH3)∶n(CO2)≥3,这是因为 。
(5)当甲烷合成氨气的转化率为60%时,以3.0×108 L甲烷为原料能够合成 L 氨气。(假设体积均在标准状况下测定)
一定温度下,向1.0L密闭容器中加入0.60molX(g),发生反应X(g)  Y(s)+2Z(g)△H>0测得反应物X浓度与反应时间的数据如下表
Y(s)+2Z(g)△H>0测得反应物X浓度与反应时间的数据如下表
| 反应时间t/min | 0 | 1 | 2 | 3 | 4 | 6 | 8 |
| c(X)/(mol·L-1) | 0.60 | 0.42 | 0.30 | 0.21 | 0.15 | a | 0.0375 |
(1)3min时用Z表示的平均反应速率v(Z)= 。
(2)分析该反应中反应物的浓度与时间的规律,得出的结论是 。由此规律推出反应在6min时反应物的浓度a为 mol·L-1。
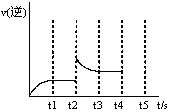
(3)反应的逆反应速率随时间变化的关系如图,t2时改变了某一种条件,改变的条件可能是 、 (填写两顶)
(4)下列哪些情况表明容器中已达平衡状态 (填字母序号)
A.容器体积一定时气体密度不再变化
B.反应的平衡常数不再变化
C.容器中气体的平均相对分子质量不随时间而变化
D.Y的物质的量不再发生变化
E.Z的生成速率等于X的消耗速率的2倍
 Si (s)+ 4HCl(g) -236kJ
Si (s)+ 4HCl(g) -236kJ 2NO2(g),经5min达到平衡,测得c(NO)=0.5mol/L,并放热Q kJ。
2NO2(g),经5min达到平衡,测得c(NO)=0.5mol/L,并放热Q kJ。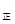 v
v (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。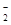 ,可以在强碱性条件下加入铝粉除去(反应过程中无气态产物生成。加热反应后的溶液有能使湿润的红色石蕊试纸变蓝的气体逸出)。请写出该反应的离子方程式____ 。
,可以在强碱性条件下加入铝粉除去(反应过程中无气态产物生成。加热反应后的溶液有能使湿润的红色石蕊试纸变蓝的气体逸出)。请写出该反应的离子方程式____ 。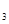 放出气泡很慢,加入少量MnO
放出气泡很慢,加入少量MnO 很快产生气体:________;
很快产生气体:________; zC达到平衡:
zC达到平衡: 2C(g)+xD(g),经过5 min后达到化学平衡,此时生成2 molC。又知在此时D的平均速率为0.15 mol·L-1·min-1。
2C(g)+xD(g),经过5 min后达到化学平衡,此时生成2 molC。又知在此时D的平均速率为0.15 mol·L-1·min-1。