题目内容
(6分)把6 molA气体和5 molB气体混合放入4L恒容密闭容器中。在一定条件下发生反应:3A(g)+B(g) 2C(g)+xD(g),经过5 min后达到化学平衡,此时生成2 molC。又知在此时D的平均速率为0.15 mol·L-1·min-1。
2C(g)+xD(g),经过5 min后达到化学平衡,此时生成2 molC。又知在此时D的平均速率为0.15 mol·L-1·min-1。
求:(1)平衡时A的物质的量浓度; (2) B的转化率;(3) x的值。(要求写出计算过程)
(1)0.75 mol·L-1 (2)20% (3)X=3
解析试题分析:(1)由方程式可知每产生2mol的 C,反应会消耗3mol的A。由于反应经过5 min后达到化学平衡,此时生成2 molC,则反应消耗了3mol的A。此时还有A3mol。则c(A)=3mol÷4L=0.75 mol/L.由方程式可知若A反应3mol,则B反应了1mol.所以B的转化率="(1mol÷5" mol)×100%=20%.(3)V(D)= 0.15 mol/( L·min),n(D)= V(D)×Δt=0.15 mol/( L·min)×4L×5 min=3mol。2:X=2:3.所以X=3.
考点:考查不同物质的化学反应速率的关系、计算及化学方程式的确定的知识。

 精英口算卡系列答案
精英口算卡系列答案工业上可以利用废气中的CO2为原料制取甲醇,其反应方程式为:CO2+3H2 CH3OH+H2O。请回答下列问题:
CH3OH+H2O。请回答下列问题:
(1)已知常温常压下下列反应的能量变化如下图所示:
|
|
|
|

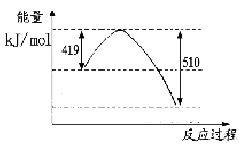 写出由二氧化碳和氢气制备甲醇的热化学方程式__ _。
写出由二氧化碳和氢气制备甲醇的热化学方程式__ _。该反应的△S____0(填“>”或“<”或“=”),在 ______情况下有利于该反应自发进行。
(2)如果上述反应方程式的平衡常数K值变大,则该反应__ (选填编号)。
A.一定向正反应方向移动 B.在平衡移动时正反应速率先增大后减小
C.一定向逆反应方向移动 D.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,能说明反应已达到平衡状态的是 __ (选填编号)。
A.3v正(H2)=v逆(CO2) B.C(H2) = C(CO2)
C.容器内气体的密度不变 D.容器内压强不变
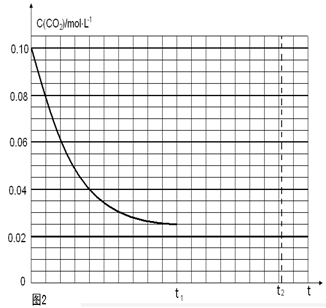
(4)若反应的容器容积为2.0L,反应时间4.0 min,容器内气体的密度增大了2.0g/L,在这段时间内CO2的平均反应速率为 。反应在t1时达到平衡,过程中c(CO2)随时间t变化趋势曲线右图所示。保持其他条件不变,t1时将容器体积压缩到1L,请画出t1后c(CO2)随时间t变化趋势曲线(t2达到新的平衡)。
联氨(N2H4)及其衍生物是一类重要的火箭燃料。N2H4与N2O4反应能放出大量的热。
(1)已知:2NO2(g) N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中此反应达到平衡。 其他条件不变时,下列措施不能使NO2转化率提高的是
N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中此反应达到平衡。 其他条件不变时,下列措施不能使NO2转化率提高的是
| A.减少NO2的浓度 | B.降低温度 | C.增加NO2的浓度 | D.升高温度 |
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)="0.0300" mol·L-1、c(N2O4)="0.0120" mol·L-1。计算反应2NO2(g)
 N2O4(g)的平衡常数K= 。
N2O4(g)的平衡常数K= 。(4)肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因 。
(5)已知在相同条件下N2H4?H2O的电离程度大于N2H5C1的水解程度。常温下,若将0.2mol/L N2H4?H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H5+、Cl-、OH-、H+离子浓度由大到小的顺序为:__________。
(6)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.肼-空气燃料电池放电时,负极的电极反应式是 ,电池工作一段时间后,电解质溶液的pH将 (填“增大”、“减小”、“不变”)。
(16分)某小组同学利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,倒入大试管中迅速振荡混合均匀,再加入硫酸,开始计时,通过测定混合溶液褪色所需时间来判断反应的快慢(已知反应方程式为:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O)。该小组设计了如下方案。
| 编号 | H2C2O4溶液 | KMnO4溶液 | 硫酸溶液 | 温度/℃ | ||
| | 浓度 (mol/L) | 体积 (mL) | 浓度 (mol/L) | 体积 (mL) | | |
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 4mL 4mol/L | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 4mL 4mol/L | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 4mL 4mol/L | 50 |
(2)该小组同学由此实验发现反应进行一些时间后,有一时间段反应速率不断加快。同学们分析除了反应放热使体系温度升高外,可能还有其它原因,他们联想到教材上的科学探究实验,推断出反应混合溶液中的__________(填化学式)也加速了此反应的进行。
(3)上述实验①中充分反应后H2C2O4过量,假设理论上能通过用酸性KMnO4溶液滴定的方法来测定反应混合液中过量的H2C2O4,请回答下列问题:
①取用反应混合液的滴定管用__________滴定管(填“酸式”或“碱式”,下同),盛装KMnO4溶液的滴定管用__________滴定管。
②下列操作中可能使测出的H2C2O4剩余量比理论值偏低的是__________。
A.读取酸性KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
B.滴定前盛放反应混合液的锥形瓶用蒸馏水洗净但没有干燥
C.盛装KMnO4溶液的滴定管滴定前有气泡,滴定后气泡消失
D.盛装KMnO4溶液的滴定管未润洗就直接注入酸性KMnO4溶液
③此滴定实验是否需要滴加指示剂________(填“是”或“否”);怎么确定此滴定的终点:_________。


 N2O4(g)的平衡常数K= ,若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为 。
N2O4(g)的平衡常数K= ,若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为 。


 的化学平衡常
的化学平衡常 。
。
 2C(g),达平衡后生成1.2mol C,平衡混合气体中C的体积分数为ω。
2C(g),达平衡后生成1.2mol C,平衡混合气体中C的体积分数为ω。 2Z(气),压强一定时,测得在平衡时Z的体积分数为0.4。
2Z(气),压强一定时,测得在平衡时Z的体积分数为0.4。