题目内容
用纯净的碳酸钙跟稀盐酸反应制取二氧化碳气体,请回答:
(1)实验过程如右图所示,分析判断: 段化学反应速率最快, 段收集的二氧化碳最多。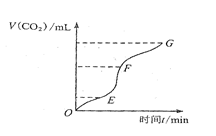
(2)为了减缓上述化学反应的速率,欲向溶液中加入下列物质,你认为可行的是( )
| A.蒸馏水 | B.NaCl固体 | C.NaCl溶液 | D.浓盐酸 |
(1)EF (1分) EF (1分)(2)AC (2分)
(3)改用较大块的碳酸钙固体,或用于盐酸板应的东西把碳酸钙部分包住等(1分)
解析试题分析:(1)用纯净的碳酸钙跟稀盐酸反应制取二氧化碳气体,从图中可以看出EF段比较陡,故EF段的化学反应速率最快,化学反应速率快,则生成的二氧化碳最多;(2)加入蒸馏水,使得反应物的浓度减小,故化学反应速率减小,故A可以选;加入NaCl固体,对该反应的反应速率没有影响,故B不能选;加入NaCl溶液,使得反应物的浓度减小,故化学反应速率减小,故C可以选;加入浓盐酸,则化学反应速率增大,故D不可以选,所以本题选择AC;(3)除了上述方法外,还可以改用较大块的碳酸钙固体,或用于盐酸板应的东西把碳酸钙部分包住,或者是减低温度等等,只要合理即可。
考点:化学反应速率、影响化学反应速率的因素,本题考查了化学反应速率、影响化学反应速率的因素,该考点是高考考查的重点和难点,本题难度不大。

 阅读快车系列答案
阅读快车系列答案工业上利用CO和水蒸气在一定条件下发生反应制取氢气:CO(g)+H2O(g) CO2(g)+H2(g)某研究小组分别在体积均为2L的恒容密闭容器中加入一定量的反应物,使其发生反应,相关数据如下:
CO2(g)+H2(g)某研究小组分别在体积均为2L的恒容密闭容器中加入一定量的反应物,使其发生反应,相关数据如下:
| 容器编号 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡的时间/min | 达到平衡时体系能量的变化/kJ | ||
| CO | H2O | CO2 | H2 | ||||
| ① | 650 | 1 | 2 | 0.4 | 0.4 | 5 | 16.4 |
| ② | 650 | 2 | 4 | | | t1 | Q1 |
| ③ | 900 | 2 | 4 | 1.6 | 1.6 | t2 | Q2 |
(2)容器③中反应达平衡时,CO的转化率为____________。
(3)容器①中反应达平衡这段时间,化学反应速率
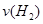 =__________。
=__________。(4)该反应的正反应为_______(填“吸热”或“放热”)反应,理由是____________。
(5)下列叙述正确的是____________(填字母序号)。
a.平衡时,容器①和容器②中CO2的体积分数相等
b.反应达平衡状态时,Q2>Q1>32.8kJ
c.达到平衡的时间:t2>t1>2.5min
d.该反应的热化学方程式可表示为:CO(g)+H2O(g)
 CO2(g)+H2(g) △H= -41kJ/mol
CO2(g)+H2(g) △H= -41kJ/mol 在1.0 L密闭容器中放入0.10 mol A(g),在一定温度进行如下反应应:
A(g) B(g)+C(g) △H ="+85.1" kJ· mol-1
B(g)+C(g) △H ="+85.1" kJ· mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为 。
(2)由总压强P和起始压强P0计算反应物A的转化率α(A)的表达式为 。
平衡时A的转化率为 ,列式并计算反应的平衡常数K 。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),
n总= mol,n(A)= mol。
②下表为反应物A浓度与反应时间的数据,计算a=
| 反应时间t/h | 0 | 4 | 8 | 16 |
| c(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.0065 |
煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。已知:
CO(g)+H2O(g) H2(g)+CO2(g)平衡常数随温度的变化如下表:
H2(g)+CO2(g)平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
试回答下列问题
(1)上述正向反应是 反应 (填“放热”或“吸热”)
(2)要使上述反应的逆反应速率增大且平衡正反应方向移动,下列措施不可行的有
A、加入催化剂 B、增大CO的物质的量以提高体系的压强
C、降低温度 D、减小H2的浓度
(3)向某密闭容器中充入2molCO和4molH2O(g),发生反应:CO(g)+H2O(g)
 H2(g)+CO2(g),当反应达平衡时,CO的体积分数为X,若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数不等于X的有
H2(g)+CO2(g),当反应达平衡时,CO的体积分数为X,若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数不等于X的有 A、1molCO(g)+4molH2O+2molCO2(g)+2molH2(g) B、2molCO(g)+2molH2O+2molCO2(g)+2molH2(g)
C、1molCO(g)+3molH2O+0.8molCO2(g)+0.8molH2(g) D、1molCO(g)+3molH2O+1molCO2(g)+1molH2(g)
(4)若反应在800℃时进行,设起始CO和H2O(g)共为5mol,水蒸气的体积分数为X;平衡时CO的转化率为y,则y随x变化的函数关系式为y=
(5)在VL密闭容器中通入10mol CO和10mol水蒸气,在T℃达到平衡,然后急速通过碱石灰,将所得混合气体燃烧,测得放出的热量为2845KJ(已知CO燃烧热为283KJ/mol,H2燃烧热为286KJ/mol),则T℃平衡常数K= ,T= K(0℃时T=273K)
 2NH3(g) ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一个固定容积的密闭容器中发生反应,反应过程中各种物质的量浓度变化如图所示,回答下列问题:
2NH3(g) ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一个固定容积的密闭容器中发生反应,反应过程中各种物质的量浓度变化如图所示,回答下列问题: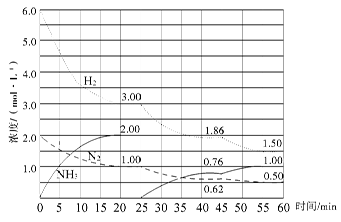
 CH3OH ( g ) △H=-116kJ/mol
CH3OH ( g ) △H=-116kJ/mol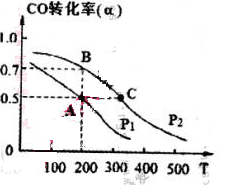
 xC(g) ΔH 有:
xC(g) ΔH 有:
 C(g),平衡时C 的体积分数为40℅。
C(g),平衡时C 的体积分数为40℅。