题目内容
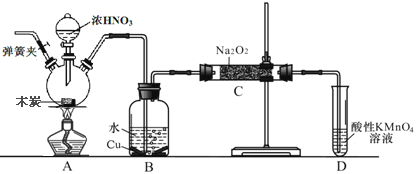
【题目】亚硝酸钠在漂白、电镀等方面应用广泛。现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如图所示(部分夹持装置略)。已知:
① 3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O
② 酸性条件下,NO与NO2-都能与MnO4-反应生成NO3-和Mn2+;
(1)盛浓硝酸仪器的名称是___________________________。
(2)为避免B中逸出的气体中混有的杂质气体与Na2O2反应,应在B、C装置间增加一个装置,则该装置中盛放的药品名称为__________________。
(3)写出NO与Na2O2在常温下生成NaNO2的化学反应方程式__________________;当该反应中转移0.1mole-时,理论上吸收标准状况下NO的体积为_______L。
(4)将11.7g过氧化钠完全转化成亚硝酸钠,理论上至少需要木炭_______g。
(5)NO2易溶于水。将体积为V mL的试管充满NO2后倒扣在水中,见下图。
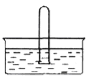
① NO2溶于水的化学方程式是______________________________________。
② 使试管中NO2完全被水吸收的操作是______________________________。
【答案】 分液漏斗(1分) 碱石灰 2NO + Na2O2 = 2NaNO2 2.24 1.8 3NO2 + H2O =2HNO3 + NO 缓缓通入V/4 mL氧气
【解析】A装置中C与HNO3(浓)反应生成二氧化碳与二氧化氮,二氧化氮在B中与水反应是硝酸,硝酸与Cu反应生成NO,C装置中制备NaNO2,由于二氧化碳、水蒸气与过氧化钠反应的得到碳酸钠、氢氧化钠,故需要需要除去二氧化碳,并干燥NO气体,可以在B、C之间添加盛放碱石灰的装置,反应开始需要排尽装置中的空气,防止氧气将NO氧化。利用酸性高锰酸钾溶液溶液氧化未反应的NO,可以防止污染空气,由题目信息,酸性条件下,NO与NO2-都能与MnO4-反应生成NO3-和Mn2+。
(1)根据装置图可知盛浓硝酸仪器的名称为分液漏斗;(2)因为一氧化氮中混有二氧化碳和水蒸汽,二氧化碳和过氧化钠发生的反应生成碳酸钠和氧气,水与过氧化钠反应生成氢氧化钠,为避免产生这些副产物,应在B、C装置间增加一个盛有碱石灰(或氢氧化钠固体或氧化钙固体)的装置,用来吸收二氧化碳和水蒸气;(3)根据电子得失守恒及元素守恒可知NO与Na2O2在常温下生成NaNO2的化学反应方程式为2NO+Na2O2= NaNO2,反应中N元素化合价由+2价升高为+3价,当反应中转移0.1mol电子时,吸收NO的物质的量为0.1mol,则NO的体积为2.24L;(4)根据C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O,3NO2+H2O=2HNO3+NO可得关系式C~4NO2~4/3NO~8/3HNO3,根据3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,有关系式HNO3~3/8Cu~1/4NO,则有C~2/3NO,所以碳与总的NO的关系式为C~2NO,根据2NO+Na2O2=2NaNO2可知碳与Na2O2的关系式为C~Na2O2,所以11.7g过氧化钠完全转化成为亚硝酸钠,理论上至少需要碳的质量为11.7/78×12g=1.8g;(5)①NO2与水反应生成一氧化氮和硝酸,反应的化学方程式是3NO2+H2O=2HNO3+NO。②根据反应4NO2+H2O+O2=4HNO3可知要使此试管中NO2完全被水吸收可向试管中缓缓通入V/4 mL氧气。
CO2↑+4NO2↑+2H2O,3NO2+H2O=2HNO3+NO可得关系式C~4NO2~4/3NO~8/3HNO3,根据3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,有关系式HNO3~3/8Cu~1/4NO,则有C~2/3NO,所以碳与总的NO的关系式为C~2NO,根据2NO+Na2O2=2NaNO2可知碳与Na2O2的关系式为C~Na2O2,所以11.7g过氧化钠完全转化成为亚硝酸钠,理论上至少需要碳的质量为11.7/78×12g=1.8g;(5)①NO2与水反应生成一氧化氮和硝酸,反应的化学方程式是3NO2+H2O=2HNO3+NO。②根据反应4NO2+H2O+O2=4HNO3可知要使此试管中NO2完全被水吸收可向试管中缓缓通入V/4 mL氧气。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列说法正确的是( )
A.在100℃、101kPa条件下,液态水的气化热为40.69kJmol﹣1 , 则H2O(g)H2O(l)的△H=40.69kJmol﹣1
B.常温下,在0.10molL﹣1的NH3H2O溶液中加入少量NH4Cl晶体,能使NH3H2O的电离度降低,溶液的pH减小
C.已知:
共价键 | C﹣C | C=C | C﹣H | H﹣H |
键能/kJmol﹣1 | 348 | 610 | 413 | 436 |
则反应 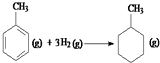 的焓变为△H=[(4×348+3×610+8×413)+3×436﹣(7×348+14×413)]kJmol﹣1=﹣384kJmol﹣1
的焓变为△H=[(4×348+3×610+8×413)+3×436﹣(7×348+14×413)]kJmol﹣1=﹣384kJmol﹣1
D.已知MgCO3的Ksp=6.82×10﹣6 , 则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32﹣),且c(Mg2+)c(CO32﹣)=6.82×10﹣6