题目内容
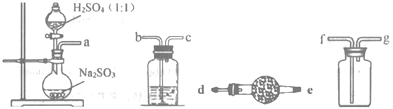
【题目】实验室可用Na2SO3固体与浓硫酸反应制取SO2,用如图所示装置完成SO2性质性质的探究,请按要求完成填空:
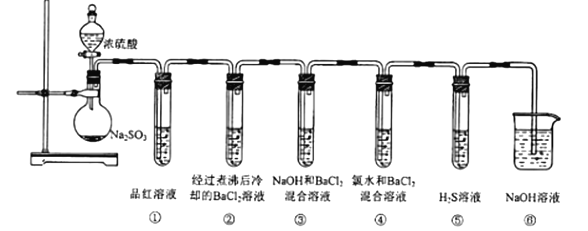
(1)实验中试管①中品红溶液褪色,实验结束后将试管①取下,置于沸水浴中加热,可观察到的实验现象为__。
(2)试管②中无明显现象,而试管③中出现白色沉淀,该沉淀的化学式为___。
(3)试管④中产生白色沉淀,写出其中发生反应的离子方程式:__和___。
(4)试管⑤中出现淡黄色沉淀,证明SO2具有__性。
(5)试管⑥的作用为__。
【答案】溶液恢复成原来的红色 BaSO3 SO2 +Cl2 +2H2O=4H++SO42-+2Cl- SO42-+Ba2+=BaSO4↓ 氧化 吸收多余的SO2,防止污染环境
【解析】
浓硫酸和Na2SO3反应生成SO2,SO2使品红溶液褪色,验证漂白性,SO2不和BaCl2反应,但有NaOH存在时会反应生成BaSO3沉淀,氯水和SO2反应生成H2SO4和HCl,H2SO4和BaCl2反应生成BaSO4沉淀,SO2与H2S反应生成S单质,体现SO2的氧化性,最后NaOH与SO2反应处理尾气。
⑴实验中试管①中品红溶液褪色,实验结束后将试管①取下,置于沸水浴中加热,可观察到的实验现象为溶液恢复成原来的红色;
⑵试管②中无明显现象,而试管③中出现白色沉淀,是由于SO2和NaOH反应生成Na2SO3,Na2SO3和BaCl2反应生成BaSO3和NaCl,因此该沉淀的化学式为BaSO3;
⑶试管④中产生白色沉淀,是由于SO2和氯水中氯气反应生成H2SO4和HCl,H2SO4和BaCl2反应生成BaSO4和HCl,发生反应的离子方程式:SO2+Cl2+2H2O=4H++SO42-+2Cl-和SO42-+Ba2+=BaSO4↓;
⑷试管⑤中出现淡黄色沉淀,说明SO2化合价降低,证明SO2具有氧化性;
⑸试管⑥的作用为吸收多余的SO2,防止污染环境。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案【题目】已知25 ℃时有关弱酸的电离平衡常数见下表:
弱酸化学式 | HA | H2B |
电离平衡常数(25 ℃) | Ka=1.7×10-6 | Ka1=1.3×10-3 Ka2=5.6×10-8 |
则下列有关说法正确的是( )
A.NaHB溶液中部分微粒浓度的大小为:c(Na+)>c(HB-)>c(B2-)>c(H2B)
B.等物质的量浓度的各溶液pH关系为:pH(Na2B)>pH(NaHB)>pH(NaA)
C.向Na2B溶液中加入足量的HA溶液发生反应的离子方程式为:B2-+2HA=2A-+H2B
D.将a mol/L的HA溶液与a mol/L的NaA溶液等体积混合,混合液中:c(Na+)>c(A-)
【题目】某学生为探究AgCl沉淀的溶解和转化,其实验方案及记录如下:
步骤和现象 | 现象 |
Ⅰ.将等体积等浓度的AgNO3溶液和NaCl溶液混合,过滤,得滤液X和白色沉淀Y | |
Ⅱ.向滤液X 中滴加几滴饱和KI溶液 | 生成黄色沉淀M |
Ⅲ.取少量白色沉淀Y,滴加几滴饱和Na2S溶液 | 沉淀Y 转化为黑色沉淀Z |
Ⅳ.取少量白色沉淀Y,滴加几滴浓氨水 | 沉淀Y逐渐溶解 |
(1)由步骤Ⅱ的现象可推测,滤液 X 中除了含有Na+、NO3-,还含有的离子有_____。
(2)写出步骤Ⅲ中生成黑色沉淀 Z 的离子方程式为_________________,白色沉淀Y 转化为黑色沉淀 Z 的主要原因是___________。
(3)已知:Ag+ + 2NH3· H2OAg(NH3)2++2H2O,用平衡移动原理解释步骤Ⅳ中加入浓氨水沉淀逐渐溶解的原因__________________。
(4)为了进一步探究银的难溶化合物沉淀溶解的多样性,该同学又做了如下对比实验 V:
①取少量黑色沉淀 Z 和黄色沉淀 M,分置于两支试管中
②然后分别滴加同体积同浓度的稀硝酸,观察到黄色沉淀 M 不溶解,黑色沉淀 Z 溶解,并且有无色气体产生。综合实验Ⅱ至实验 V 的信息,下列预测正确的是__________
A.黑色沉淀 Z 比黄色沉淀 M 更难溶于水
B.黑色沉淀 Z 溶解于稀硝酸是因为发生了氧化还原反应
C.由步骤Ⅳ可以推测:实验室可用氨水洗涤银镜反应后的试管
D.在步骤Ⅳ之后,继续滴加浓硝酸后又有 AgCl 沉淀生成