题目内容
根据金属活动性顺序,Ag不能发生反应:2HCl +2Ag =2AgCl+H2↑。但选择恰当电极材料和电解液进行电解,这个反应就能变为现实。下列四组电极和电解液中,为能实现该反应最恰当的是( )
C
解析试题分析:“2HCl +2Ag =2AgCl+H2↑”是非自发进行的,Ag要生成Ag+,做原电池阳极,接电源正极,H+生成H2是在阴极。故选择C。
考点:化学反应方程式与电化学反应装置的关系。

练习册系列答案
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
用惰性电极电解一定浓度的CuSO4溶液时,通电一段时间后,向所得的溶液中加入0.1mol Cu2 (OH)2CO3后恰好恢复到电解前的浓度和pH (不考虑二氧化碳的溶解)。则电解过程中转移的电子的物质的量为:
| A.0.4mol | B.0.5mol | C.0.6mol | D.0.8mol |
下列关于下图所示原电池装置的叙述中,正确的是( ) 
| A.铜片作负极,质量逐渐减小 | B.溶液的pH逐渐减小 |
| C.电流从锌片经导线流向铜片 | D.氢离子在铜片表面被还原 |
按下图所示装置进行有关实验,则下列叙述正确的是
| A.甲装置用作原电池时,锌为正极 |
| B.甲装置用作原电池时,银棒上发生:Ag+ +e-= Ag |
| C.乙装置用作铜片镀镍时,镍作阴极 |
| D.实现铜片表面镀镍时,可将甲中锌棒与乙中铜片相连,甲中银棒与乙中镍片相连 |
下列关于原电池的叙述中,正确的是( )
| A.把电能转化为化学能,使溶液发生氧化还原反应 |
| B.电子从活泼金属流向不活泼金属,不活泼金属为负极 |
| C.外电路中电子从负极流向正极 |
| D.正极发生氧化反应 |
在下图所示的原电池中,下列说法错误的是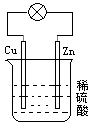
| A.溶液的pH逐渐变小 | B.负极附近SO42-离子浓度逐渐增大 |
| C.正极有H2逸出 | D.正极质量无变化 |
X、Y、Z和M代表四种金属元素。金属X和Z用导线连接放入稀硫酸中时,Z极上有H2放出;若电解Y2+和Z2+共存的溶液时,Y先析出;又知M2+的氧化性强于Y2+。则这四种金属的活动性由强到弱的顺序为( )
| A.X>Z>Y>M | B.X>Y>Z>M | C.M>Z>X>Y | D.X>Z>M>Y |
将纯锌片和纯铜片按下图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是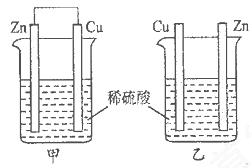
| A.两烧杯中铜片表面均无气泡产生 | B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中溶液的酸性均减弱 | D.产生气泡的速率甲比乙慢 |
