题目内容
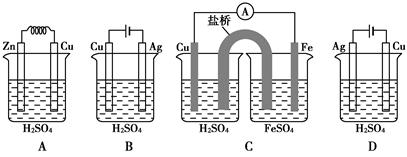
将纯锌片和纯铜片按下图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是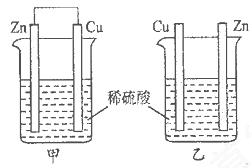
| A.两烧杯中铜片表面均无气泡产生 | B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中溶液的酸性均减弱 | D.产生气泡的速率甲比乙慢 |
C
解析试题分析:A、甲烧杯可以形成原电池,Cu作正极,有气泡产生,错误;B、乙不是闭合回路,不能形成原电池,不存在正负极,错误;C、2个装置中的反应的实质都是Zn与氢离子反应生成氢气,所以酸性均减弱,正确;D、甲发生的是电化学反应,乙发生的是化学反应,电化学反应速率比化学反应速率快,错误,答案选C。
考点:考查对原电池的判断,电极反应及现象的判断,反应速率的判断

练习册系列答案
相关题目
某氢氧燃料电池的电解液是热的KOH溶液,在正极上氧气被还原,在负极上氢气被氧化,下列有关该电池的叙述正确的是
| A.负极反应式为:H2+2OH- -2e- =2H2O |
| B.正极反应式为:O2 +4H+十4e- =2H2O |
| C.工作一段时间后,KOH溶液的浓度不变 |
| D.电池工作时,电子由正极通过外电路流向负极 |
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图。下列有关氢氧燃料电池的说法不正确的是( )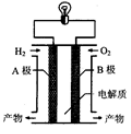
| A.A电极是负极 |
| B.外电路中电子由B电极通过导线流向A电极 |
| C.产物为无污染的水,属于环境友好电池 |
| D.该电池的总反应:2H2+O2===2H2O |
如图是甲醇/过氧化氢燃料电池内部结构示意图。 工作时,甲醇和过氧化氢分别进入燃料电池的燃料腔和氧化剂腔,在各自催化剂的作用下发生反应,并向外界输出电能。下列说法不正确的是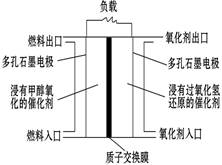
| A.该电池的正极反应式:H2O2+2H++2e—=2H2O |
| B.燃料腔中的多孔石墨电极为该燃料电池的负极,负极产生的H+通过质子交换膜流向正极 |
| C.电池工作时,1 mol甲醇被氧化有6 mol电子转移 |
| D.电路中的电子经正极、负极、质子交换膜后再回到正极,形成闭合回路 |
以石墨为电极,电解KI溶液(其中含有少量酚酞和淀粉)。下列说法错误的是
| A.阴极附远溶液呈红色 | B.阴极逸出气体 |
| C.阳极附近溶液呈蓝色 | D.溶液的pH变小 |
在水中加入等物质的量的Ag+、Pb2+、Na+、SO42-、NO3-、Cl-,该溶液放在用惰性电极材料做电极的电解槽中,通电片刻,则氧化产物与还原产物质质量比为…( )
| A.35.5:108 | B.16:207 | C.8:1 | D.108:35.5 |

 2CO2+4H2O。下列关于该电池的分析:①甲醇是负极②H+向负极移动③负极反应:CH3OH-6e-+H2O=CO2+6H+ ④1 mol CH3OH完全反应转移12 mol电子 ⑤正极反应:O2+4e-+2H2O==4OH-⑥该电池的电解质溶液可能是碱液。其中正确的是
2CO2+4H2O。下列关于该电池的分析:①甲醇是负极②H+向负极移动③负极反应:CH3OH-6e-+H2O=CO2+6H+ ④1 mol CH3OH完全反应转移12 mol电子 ⑤正极反应:O2+4e-+2H2O==4OH-⑥该电池的电解质溶液可能是碱液。其中正确的是