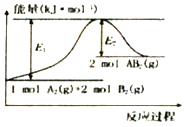
题目内容
【题目】根据要求回答下列问题:
(1)生活中明矾常作净水剂,其净水的原理是___(用离子方程式表示)。
(2)在25℃时,pH等于9和pH等于11的两种氢氧化钠溶液等体积混合后(忽略溶液体积的变化),溶液中的氢离子浓度为___。
(3)现将0.2mol·L-1的NH3·H2O溶液与0.1mol·L-1的HCl溶液等体积混合,写出该混合溶液质子守恒式:___。
(4)FeCl2溶液蒸干并灼烧得到的物质是___(填化学式)。
(5)浓度均为0.1molL﹣1的①H2S、②NaHS、③Na2S、④H2S和NaHS混合液,溶液pH从大到小的顺序是___。(用序号表示)
(6)在常温下,现有下列四种溶液:①0.1mol·L-1 CH3COONH4溶液,②0.1mol·L-1NH4HSO4溶液,③0.1mol·L-1 NH3·H2O和0.1mol·L-1 NH4Cl混合溶液,④0.1mol·L-1 NH3·H2O溶液。比较①、②、③、④溶液中c(NH4+)由小到大的顺序为___(用序号表示)
【答案】Al3++3H2OAl(OH)3(胶体)+3H+ 2×10-11mol·L-1 c(NH3·H2O)+ c(OH-)= c(H+)+ c(Cl-) Fe2O3 ③>②>④>① ④<①<②<③
【解析】
(1)明矾中含有铝离子,易水解生成氢氧化铝胶体,胶体吸附水中的悬浮物而净水;
(2)先计算混合溶液中c(OH-),再根据Kw=c(OH-)·c(H+)计算c(H+);
(3)0.2mol/LNH3·H2O与0.1mol/L的HCI溶液等体积混合,NH3·H2O过量,生成的氯化铵和剩余一水合氨的物质的量相等,根据混合溶液中电荷守恒和物料守恒式关系可得到质子守恒式,据此分析。
(4)FeCl2为强酸弱碱盐,在溶液中亚铁离子水解生成氢氧化亚铁,加入过程中与空气中的氧气反应转化为氢氧化铁,蒸干后在进行灼烧,氢氧化铁受热分解生成三氧化二铁;
(5)①H2S,硫化氢在溶液中部分电离出氢离子,溶液显示酸性;②NaHS溶液中,硫氢根离子的电离程度需要水解程度,溶液显示碱性;③Na2S溶液中硫离子水解,溶液显示碱性,且硫离子水解程度大于硫氢根离子,溶液的pH大于②;④H2S和NaHS混合液,硫化氢的电离程度大于硫氢根离子的水解,溶液显示酸性,由于硫氢根离子抑制了硫化氢的电离,则溶液酸性小于①,据此判断溶液的pH;
(6)①0.1mol·L-1 CH3COONH4溶液中NH4+水解,且CH3COO-促进NH4+水解;②0.1mol·L-1NH4HSO4溶液可电离出NH4+、H+、SO42-,其中NH4+水解,H+抑制NH4+水解;④0.1mol·L-1 NH3·H2O溶液中,可微弱的电离出铵根离子,因此c(NH4+):②>①>④;③0.1mol·L-1 NH3·H2O和0.1mol·L-1 NH4Cl混合溶液中铵根离子浓度最大。
(1)明矾溶于水电离出铝离子,铝离子易水解生成氢氧化铝胶体,胶体具有吸附性,能吸附水中的悬浮物而净水,所以明矾能净水,离子方程式为Al3++3H2OAl(OH)3(胶体)+3H+,
故答案为Al3++3H2OAl(OH)3(胶体)+3H+;
(2)pH=9的溶液中c(OH)=![]() mol/L=103mol/L,pH=11的溶液中c(OH)=
mol/L=103mol/L,pH=11的溶液中c(OH)=![]() mol/L=105mol/L,则等体积混合溶液中c(OH)=
mol/L=105mol/L,则等体积混合溶液中c(OH)=![]() mol/L,混合溶液中c(H+)=
mol/L,混合溶液中c(H+)=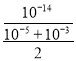 mol/L≈2×1011mol/L,
mol/L≈2×1011mol/L,
答案为:2×1011mol/L;
(3)将0.2mol·L-1的NH3·H2O溶液与0.1mol·L-1的HCl溶液等体积混合,NH3·H2O过量,生成的氯化铵和剩余一水合氨的物质的量相等,在混合溶液中,电荷守恒: c(H+) +c(NH4+)=c(OH-)+c(Cl-);物料守恒: c(NH4+) +c(NH3·H2O)=2c(Cl-);则质子守恒式=物料守恒式-电荷守恒式,则该混合溶液质子守恒式:c(NH3·H2O)+ c(OH-)= c(H+)+ c(Cl-),
答案为:c(NH3·H2O)+ c(OH-)= c(H+)+ c(Cl-);
(4)FeCl2为强酸弱碱盐,在溶液中亚铁离子水解生成氢氧化亚铁,加入过程中与空气中的氧气反应转化为氢氧化铁,蒸干后在进行灼烧,氢氧化铁受热分解生成三氧化二铁,化学式为:Fe2O3,
答案为:Fe2O3;
(5)①H2S、④H2S和NaHS的溶液显示酸性,溶液中pH<7,由于④中硫氢根离子抑制了硫化氢的电离,则④中氢离子浓度小于①,则溶液的pH:①<④,②NaHS和NaHS、③Na2S的溶液显示碱性,由于酸性硫化氢大于硫氢根离子,则③的水解程度大于②,所以溶液的pH:③>②,故四种溶液的pH从大到小的顺序为:③>②>④>①,
故答案为③>②>④&t;①;
(6)①0.1mol·L-1 CH3COONH4溶液中NH4+水解,且CH3COO-促进NH4+水解;②0.1mol·L-1NH4HSO4溶液可电离出NH4+、H+、SO42-,其中NH4+水解,H+抑制NH4+水解;④0.1mol·L-1 NH3·H2O溶液中,可微弱的电离出铵根离子,因此c(NH4+):②>①>④;③0.1mol·L-1 NH3·H2O和0.1mol·L-1 NH4Cl混合溶液中铵根离子浓度最大,则以上溶液中c(NH4+)由小到大的顺序为④<①<②<③,
答案为:④<①<②<③。

【题目】下表中实验操作、现象以及所得出的结论都正确的是![]()
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 向盛有 | 先出现白色沉淀,后出现黄色沉淀 |
|
B | 将适量 | 一支试管出现白色沉淀,另一支试管无明显现象 | 出现的白色沉淀是 |
C | 取少量 | 产生白色沉淀 |
|
D | 湿润的KI淀粉试纸靠近气体Y | 试纸变蓝 | Y可能是 |
A.AB.BC.CD.D
【题目】草酸![]() 溶液与酸性
溶液与酸性![]() 溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
(查阅资料)![]() 溶液氧化
溶液氧化![]() 的反应历程为:
的反应历程为:
![]()
(提出假设)假设1:该反应为放热
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是______。
(设计、完成实验)
![]() 称取______g草酸晶体
称取______g草酸晶体![]() ,配置500mL
,配置500mL![]()
![]() 溶液。
溶液。
①在上述过程中必须用到的2种定量仪器是托盘天平和______。
②下列操作会使所配溶液浓度偏低的是______![]() 填下列选项的字母序号
填下列选项的字母序号![]() 。
。
A 称取草酸晶体时,将草酸晶体放在托盘天平右盘
B 定容时俯视刻度线
C 将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
D 摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容
![]() 完成探究,记录数据
完成探究,记录数据
实验 编号 | 烧杯中所加试剂及用量 | 控制条件 | 溶液褪 色时间
| |||
| 等浓度
|
|
稀硫酸 | |||
1 | 30 | 20 | 30 | 20 | 18 | |
2 | 30 | 20 | 30 | 20 | 水浴控制温度 | 15 |
3 | 30 | 20 | 30 | 20 | 加入少量 |
|
4 | 30 | 20 | x | 20 | 加入5mL
| 18 |
则![]() ______,假设______成立。
______,假设______成立。
![]() 由于
由于![]() 能氧化水中有机物等因素,配置好稳定的
能氧化水中有机物等因素,配置好稳定的 溶液,其浓度需标定.取
溶液,其浓度需标定.取![]()
![]()
![]() 溶液于锥形瓶中,加入10mL
溶液于锥形瓶中,加入10mL![]() 稀硫酸,用
稀硫酸,用![]() 中
中![]() 溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗
溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗![]() 溶液
溶液![]() ,则草酸溶液与酸性
,则草酸溶液与酸性![]() 溶液反应的离子方程式为:______,上述实验中
溶液反应的离子方程式为:______,上述实验中![]() 溶液的物质的量浓度为______。
溶液的物质的量浓度为______。