题目内容
【题目】大力发展电动汽车,可以有效控制空气污染。目前机动车常使用的电池有铅蓄电池、锂电池等。
I.铅蓄电池充放电的总反应为:PbO2+Pb+2H2SO4![]() 2PbSO4+2H2O。锂硫电池充放电的总反应为:2Li+S
2PbSO4+2H2O。锂硫电池充放电的总反应为:2Li+S![]() Li2S。
Li2S。
(1)铅蓄电池的负极材料为________________________。
(2)当消耗等质量的负极活性物质时,锂硫电池的理论放电量是铅蓄电池的___________倍。(保留三位有效数字)
II.由方铅矿(PbS)制备铅蓄电池电极材料(PbO2)的方法如下:
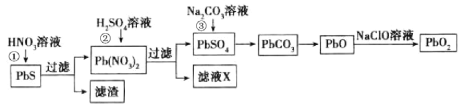
(3)步骤①酸溶时,为提高酸溶速率,可采取的措施是____________ (任写一条)。
(4)已知 25℃时,Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13。若步骤②沉铅后的滤液中c(Pb2+)=1.82×10-6 mol·L-1,则此时c(![]() )=_____________ mol·L-1。
)=_____________ mol·L-1。
(5)步骤③向PbSO4中加Na2CO3溶液会发生:PbSO4(s)+![]() (aq)=PbCO3(s)+
(aq)=PbCO3(s)+![]() (aq)。列式并计算该反应此温度下的平衡常数K=______________(写出K的表达式、代入数据、算出结果、保留三位有效数字)
(aq)。列式并计算该反应此温度下的平衡常数K=______________(写出K的表达式、代入数据、算出结果、保留三位有效数字)
(6)以石墨为电极电解Pb(NO3)2溶液也可以制得PbO2。PbO2将在__________极生成(填“阴”或“阳”);而另一极存在电极反应Pb2++2e-=Pb,故Pb元素的利用率较低。若在Pb(NO3)2溶液中加入适量Cu(NO3)2则可有效利用Pb2+,其理由是_____________________________________________________。
【答案】Pb 14.8 将矿石粉碎、提高酸的浓度、升高温度(任写一条)。 0.01mol·L-1 1.25×105 阳 铜离子在阴极放电生成单质铜,避免了铅离子放电,从而大大提高铅离子的利用率
【解析】
I.(1)放电时,铅蓄电池的负极发生氧化反应,铅离子与溶液中的硫酸根离子生成难溶的硫酸铅,电极反应式为:Pb-2e-+SO42-=PbSO4,铅蓄电池的负极材料为Pb。
(2)铅蓄电池中铅是负极,207g铅消耗时转移2mol e-,故锂硫电池的理论放电量是铅蓄电池的:207÷14=14.8倍;
Ⅱ.(3)①酸溶时,为提高酸溶速率,可采取的措施是将矿石粉碎、提高酸的浓度、升高温度(任写一条)。
(4)已知25℃时,Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13。若步骤②沉铅后的滤液中c(Pb2+)=1.82×10-6 mol·L-1,则此时c(![]() )=1.82×10-8÷1.82×10-6=0.01mol·L-1。
)=1.82×10-8÷1.82×10-6=0.01mol·L-1。
(5)平衡常数K=![]() =
=![]() =
=![]() =1.25×105;
=1.25×105;
(6)电解时,阳极上铅离子失电子和水反应生成二氧化铅,电极反应式为Pb2++2H2O-2e-=PbO2↓+4H+,阴极发生Pb2++2e-=Pb,加入硫酸铜,铜离子在阴极放电生成单质铜,避免了铅离子放电,从而大大提高铅离子的利用率。

【题目】剧毒物氰化钠(NaCN)固体遇水或酸生成剧毒易燃的 HCN 气体,同时 HCN 又能与水互溶,造成水污染。已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 |
Ka2=5.6×10-11 |
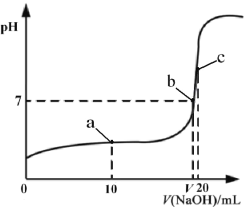
下列选项错误的是( )
A.向NaCN溶液中通入少量CO2发生的离子反应为2CN-+H2O+CO2=2HCN+![]()
B.相同浓度的 HCOOH和NaCN 的溶液中,水的电离程度前者小
C.中和等体积、等pH 的 HCOOH 溶液和 HCN 溶液消耗 NaOH 的物质的量前者小于后者
D.等体积、等物质的量浓度的 HCOONa 和 NaCN 溶液中所含离子总数前者大于后者
【题目】已知某气态化石燃料X中只含有碳、氢两种元素,为探究该气体中碳和氢两种元素的质量比,某同学设计了燃烧法测量的实验方案,通过测量装置C和D的增重即可求得碳和氢两种元素的质量比.实验装置如下图所示![]() 已知CuO可以作为碳氢化合物燃烧的催化剂
已知CuO可以作为碳氢化合物燃烧的催化剂![]() :
:

(1)若A装置中所盛放的药品是浓NaOH溶液,装置A的作用有:
①______;
②______
(2)D装置中所盛放的药品是______,
(3)E装置的作用是______,
(4)上述装置中有一处缺陷,请改正______.
(5)若实验装置经过改正后,得到的实验数据如下:
质量 | 实验前 | 实验后 |
药品 |
|
|
药品 |
|
|
则该气体中碳和氢两种元素的质量比为______.
【题目】NaCl和NaClO在酸性条件下可发生反应:![]() ,某学习小组拟研究消毒液
,某学习小组拟研究消毒液![]() 主要成分为NaCl和
主要成分为NaCl和![]() 的变质情况.
的变质情况.
(1)此消毒液中NaClO可吸收空气中的![]() 生成
生成![]() 和HClO而变质.写出化学反应方程式:______.
和HClO而变质.写出化学反应方程式:______.
(2)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出.通过以下装置检验气体的成分,从而判断该消毒液是否变质.
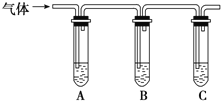
限选试剂:![]() 浓硫酸、
浓硫酸、![]() 品红溶液、
品红溶液、![]() 淀粉溶液、
淀粉溶液、![]() 溶液、澄清石灰水、饱和NaCl溶液.
溶液、澄清石灰水、饱和NaCl溶液.
请完成下列实验方案.
所加试剂 | 预期现象和结论 |
向试管A中加足量① ______ ;试管B中加 | 若A中溶液变蓝色,B中溶液不褪色,C中溶液变浑浊,则消毒液部分变质;③ ______ ,则消毒液未变质; ④ ______ ,则消毒液完全变质. |
(3)测定消毒液中NaClO的浓度.实验步骤如下:
①量取![]() 消毒液放入锥形瓶中,加入过量的
消毒液放入锥形瓶中,加入过量的![]() 溶液
溶液![]() .
.
②定量分析.使![]() 的酸性
的酸性![]() 溶液和剩余的
溶液和剩余的![]() 发生反应.重复实验3次,测得平均消耗酸性
发生反应.重复实验3次,测得平均消耗酸性![]() 溶液
溶液![]() ;此过程中涉及的反应有:
;此过程中涉及的反应有:![]() ;
;![]()
③计算.消毒液中NaClO的浓度为______![]() 用含a、b、c、V的代数式表示
用含a、b、c、V的代数式表示![]() .
.