МвДїДЪИЭ
ЎѕМвДїЎїПВ±нЦРКµСйІЩЧчЎўПЦПуТФј°ЛщµГіцµДЅбВЫ¶јХэИ·µДКЗ![]()
СЎПо | КµСйІЩЧч | КµСйПЦПу | КµСйЅбВЫ |
A | ПтКўУР | ПИіцПЦ°ЧЙ«іБµнЈ¬єуіцПЦ»ЖЙ«іБµн |
|
B | Ѕ«ККБї | Т»Ц§КФ№ЬіцПЦ°ЧЙ«іБµнЈ¬БнТ»Ц§КФ№ЬОЮГчПФПЦПу | іцПЦµД°ЧЙ«іБµнКЗ |
C | ИЎЙЩБї | ІъЙъ°ЧЙ«іБµн |
|
D | КЄИуµДKIµн·ЫКФЦЅїїЅьЖшМеY | КФЦЅ±дА¶ | YїЙДЬКЗ |
A.AB.BC.CD.D
Ўѕґр°ёЎїD
ЎѕЅвОцЎї
AЈ®КµСйІЩЧчЦРЈ¬2mL0.1molЎ¤LЈ1AgNO3ИЬТєµОИлјёµО0.1mol/LKClИЬТєЈ¬ФтИЬТєЦРµДAgЈ«№эБїЈ¬ФЩјУИлKIЈ¬IЈєНAgЈ«Ц±ЅУ·ґУ¦ЙъіЙAgIЈ¬ІўІ»КЗ°ЧЙ«µДAgClЧЄ»ЇОЄAgIЈ¬І»ДЬ±ИЅПAgClєНAgIµДKspЈ¬№КAґнОуЈ»
BЈ®SO2ИЬУЪЛ®Ј¬К№µГИЬТєПФЛбРФЈ¬SO2ѕЯУР»№ФРФЈ¬ФЪЛбРФ»·ѕіПВЈ¬±»ПхЛбёщАлЧУСх»ЇЙъіЙSO42ЈЈ¬ЙъіЙ![]() іБµнЈ¬№КBґнОуЈ»
іБµнЈ¬№КBґнОуЈ»
CЈ®ВИЛбјШУлПхЛбТшІ»·ґУ¦Ј¬ФтІ»ДЬјмСй![]() ЦРµДВИФЄЛШЈ¬У¦ПИјУИИК№ВИЛбјШ·ЦЅвЈ¬ФЩјмСйВИФЄЛШЈ¬№КCґнОуЈ»
ЦРµДВИФЄЛШЈ¬У¦ПИјУИИК№ВИЛбјШ·ЦЅвЈ¬ФЩјмСйВИФЄЛШЈ¬№КCґнОуЈ»
DЈ®ѕЯУРСх»ЇРФµДЖшМеДЬЅ«IЈСх»ЇіЙI2µДѕщїЙК№КЄИуµДKIµн·ЫКФЦЅ±дА¶Ј¬ФтЖшМеїЙДЬОЄВИЖшЎўіфСхµИЈ¬№КDХэИ·Ј»
№КСЎDЎЈ

 ФД¶БїміµПµБРґр°ё
ФД¶БїміµПµБРґр°ёЎѕМвДїЎїПВ±нКЗ3ЦЦОпЦКµДИЬЅв¶И![]() Ј¬ПВБРЛµ·ЁЦРХэИ·µДКЗ
Ј¬ПВБРЛµ·ЁЦРХэИ·µДКЗ![]()
ОпЦК |
|
|
|
ИЬЅв¶И | 74 |
|
|
A.ТСЦЄ![]() µД
µД![]()
![]() Ј¬ФтЛщУРє¬УР№ММе
Ј¬ФтЛщУРє¬УР№ММе![]() µДИЬТєЦРЈ¬¶јУР
µДИЬТєЦРЈ¬¶јУР![]() Ј¬ЗТ
Ј¬ЗТ![]()
![]()
B.іэИҐґЦСОЦРє¬УРµД![]() ФУЦКЈ¬ЧојСіэФУКФјБОЄ
ФУЦКЈ¬ЧојСіэФУКФјБОЄ![]() ИЬТє
ИЬТє
C.Ѕ«±нЦРИэЦЦОпЦКУлЛ®»мєПЈ¬јУИИЎўЧЖЙХЈ¬ЧоЦХµД№ММеІъОпПаН¬
D.УГКЇ»ТЛ®ґ¦Анє¬УР![]() єН
єН![]() µДУІЛ®Ј¬·ўЙъµДАлЧУ·ґУ¦·ЅіМКЅОЄ
µДУІЛ®Ј¬·ўЙъµДАлЧУ·ґУ¦·ЅіМКЅОЄ![]()
ЎѕМвДїЎїПВБРКµСйІЩЧчј°ПЦПуДЬµГіцПаУ¦ЅбВЫµДКЗ![]()
СЎПо | ІЩЧч | ПЦПу | ЅбВЫ |
A | Ѕ«KIєН | ПВІгИЬТєПФЧПємЙ« | Сх»ЇРФЈє
|
B | ПтКўУР | 2minєуЈ¬КФ№ЬАпіцПЦДэЅє | ·ЗЅрКфРФЈє
|
C |
| ПИіцПЦ°ЧЙ«іБµнєуУЦУРємєЦЙ«іБµнІъЙъ | ИЬЅв¶ИЈє
|
D | Пт | УРєЪЙ«іБµн | ЛбРФЈє
|
A.AB.BC.CD.D
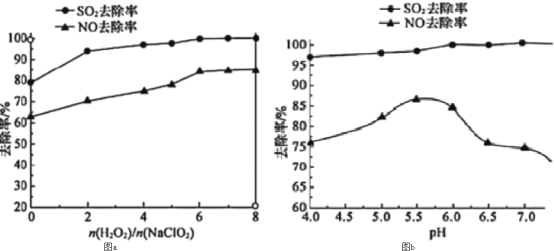
ЎѕМвДїЎїNaClєНNaClOФЪЛбРФМхјюПВїЙ·ўЙъ·ґУ¦Јє![]() Ј¬ДіС§П°РЎЧйДвСРѕїПы¶ѕТє
Ј¬ДіС§П°РЎЧйДвСРѕїПы¶ѕТє![]() ЦчТЄіЙ·ЦОЄNaClєН
ЦчТЄіЙ·ЦОЄNaClєН![]() µД±дЦКЗйїцЈ®
µД±дЦКЗйїцЈ®
(1)ґЛПы¶ѕТєЦРNaClOїЙОьКХїХЖшЦРµД![]() ЙъіЙ
ЙъіЙ![]() єНHClO¶ш±дЦКЈ®Рґіц»ЇС§·ґУ¦·ЅіМКЅЈє______Ј®
єНHClO¶ш±дЦКЈ®Рґіц»ЇС§·ґУ¦·ЅіМКЅЈє______Ј®
(2)ИЎККБїПы¶ѕТє·ЕФЪКФ№ЬЦРЈ¬јУИлЧгБїТ»¶ЁЕЁ¶ИµДБтЛбЈ¬УРЖшМе·ЕіцЈ®НЁ№эТФПВЧ°ЦГјмСйЖшМеµДіЙ·ЦЈ¬ґУ¶шЕР¶ПёГПы¶ѕТєКЗ·с±дЦКЈ®

ПЮСЎКФјБЈє![]() ЕЁБтЛбЎў
ЕЁБтЛбЎў![]() Ж·ємИЬТєЎў
Ж·ємИЬТєЎў![]() µн·ЫИЬТєЎў
µн·ЫИЬТєЎў![]() ИЬТєЎўіОЗеКЇ»ТЛ®Ўў±ҐєНNaClИЬТєЈ®
ИЬТєЎўіОЗеКЇ»ТЛ®Ўў±ҐєНNaClИЬТєЈ®
ЗлНкіЙПВБРКµСй·Ѕ°ёЈ®
ЛщјУКФјБ | Ф¤ЖЪПЦПуєНЅбВЫ |
ПтКФ№ЬAЦРјУЧгБїўЩ ______ Ј»КФ№ЬBЦРјУ | ИфAЦРИЬТє±дА¶Й«Ј¬BЦРИЬТєІ»НКЙ«Ј¬CЦРИЬТє±д»лЧЗЈ¬ФтПы¶ѕТєІї·Ц±дЦКЈ»ўЫ ______ Ј¬ФтПы¶ѕТєОґ±дЦКЈ» ўЬ ______ Ј¬ФтПы¶ѕТєНкИ«±дЦКЈ® |
(3)Ів¶ЁПы¶ѕТєЦРNaClOµДЕЁ¶ИЈ®КµСйІЅЦиИзПВЈє
ўЩБїИЎ![]() Пы¶ѕТє·ЕИлЧ¶РОЖїЦРЈ¬јУИл№эБїµД
Пы¶ѕТє·ЕИлЧ¶РОЖїЦРЈ¬јУИл№эБїµД![]() ИЬТє
ИЬТє![]() Ј®
Ј®
ўЪ¶ЁБї·ЦОцЈ®К№![]() µДЛбРФ
µДЛбРФ![]() ИЬТєєНКЈУаµД
ИЬТєєНКЈУаµД![]() ·ўЙъ·ґУ¦Ј®ЦШёґКµСй3ґОЈ¬ІвµГЖЅѕщПыєДЛбРФ
·ўЙъ·ґУ¦Ј®ЦШёґКµСй3ґОЈ¬ІвµГЖЅѕщПыєДЛбРФ![]() ИЬТє
ИЬТє![]() Ј»ґЛ№эіМЦРЙжј°µД·ґУ¦УРЈє
Ј»ґЛ№эіМЦРЙжј°µД·ґУ¦УРЈє![]() Ј»
Ј»![]()
ўЫјЖЛгЈ®Пы¶ѕТєЦРNaClOµДЕЁ¶ИОЄ______![]() УГє¬aЎўbЎўcЎўVµДґъКэКЅ±нКѕ
УГє¬aЎўbЎўcЎўVµДґъКэКЅ±нКѕ![]() Ј®
Ј®