题目内容
【题目】25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是 ( )
A.0.1 mol/LNa2CO3的溶液中:c(![]() )=2c(H2CO3)+c(H+)- c(OH-)
)=2c(H2CO3)+c(H+)- c(OH-)
B.物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=2c(![]() )+2c(
)+2c(![]() )+2c(H2CO3)
)+2c(H2CO3)
C.向3.0 L 0.1 mol·L-1 NaOH溶液中缓慢通入CO2至溶液增重8.8 g时,溶液中: c(Na+)>c(![]() )>c(
)>c(![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
D.等物质的量的CH3COOH、CH3COONa混合溶液pH=4.75中:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+)
【答案】D
【解析】
A. Na2CO3在溶液中根据物料守恒:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),溶液呈电中性可知:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-),因此有c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),故A错误;
B. 物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中,根据物料守恒:2n(Cl)=n(C),即2c(HClO)+2c(ClO-)=c(![]() )+c(
)+c(![]() )+c(H2CO3),故B错误;
)+c(H2CO3),故B错误;
C. 溶液增重的质量为二氧化碳,n(CO2)=![]() =0.2mol,NaOH溶液中含有氢氧化钠为:n(NaOH)=0.1mol·L-1×3.0L=0.3mol,1<
=0.2mol,NaOH溶液中含有氢氧化钠为:n(NaOH)=0.1mol·L-1×3.0L=0.3mol,1< =1.5<2,所以二者反应生成的是NaHCO3和Na2CO3,设n(Na2CO3)=xmol、n(NaHCO3)=ymol,根据C原子、Na原子守恒得:x+y=0.2、2x+y=0.3,解得:x=0.1、y=0.1,故反应后生成等物质的量的NaHCO3和Na2CO3,碳酸钠的水解程度大于碳酸氢钠,则:c(CO32-)<c(HCO3-),正确的离子浓度大小为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故C错误;
=1.5<2,所以二者反应生成的是NaHCO3和Na2CO3,设n(Na2CO3)=xmol、n(NaHCO3)=ymol,根据C原子、Na原子守恒得:x+y=0.2、2x+y=0.3,解得:x=0.1、y=0.1,故反应后生成等物质的量的NaHCO3和Na2CO3,碳酸钠的水解程度大于碳酸氢钠,则:c(CO32-)<c(HCO3-),正确的离子浓度大小为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故C错误;
D. 等物质的量的CH3COOH、CH3COONa混合溶液pH=4.75,溶液显酸性说明醋酸电离大于醋酸根离子水解,电荷守恒可知:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),c(Na+)>c(CH3COOH),得到c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+),故D正确;
故选D。

【题目】某化学兴趣小组借助![]() 的仪器装置完成有关实验。
的仪器装置完成有关实验。

(1)用装置A收集NO气体,正确的操作是 ______ ![]() 填序号
填序号![]() 。
。
a.从①口进气,用排水法集气
b.从①口进气,用排气法集气
c.从②口进气,用排水法集气
d.从②口进气,用排气法集气
(2)B装置中的恒压分液漏斗有两个作用,其一是平衡气压使分液漏斗内的液体能顺利滴下,其另一个作用是 ______。
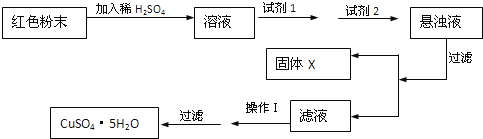
(3)三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是![]() 、
、![]() 或二者混合物。探究过程如下:
或二者混合物。探究过程如下:
查阅资料:
![]() 是一种碱性氧化物,溶于稀硫酸生成Cu和
是一种碱性氧化物,溶于稀硫酸生成Cu和![]() ,在空气中加热生成CuO
,在空气中加热生成CuO
提出假设:
假设1:红色粉末是![]()
假设2:红色粉末是![]()
假设3:红色粉末是![]() 和
和![]() 的混合物
的混合物
设计探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。
①若滴加KSCN试剂后溶液不变红色,甲同学认为原固体粉末中一定不含三氧化二铁.乙同学认为其结论不正确,乙同学的理由是 ______。
②若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则证明原固体粉末是 ______。
![]() 经分析,确定红色粉末为
经分析,确定红色粉末为![]() 和
和![]() 的混合物.实验小组欲利用该红色粉末制取较纯净的胆矾
的混合物.实验小组欲利用该红色粉末制取较纯净的胆矾![]() 。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使
。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使![]() 、
、![]() 、
、![]() 分别生成沉淀的pH如下:
分别生成沉淀的pH如下:
物质 |
|
|
|
开始沉淀pH | 6.0 |
|
|
沉淀完全pH | 13 | 14 |
|
实验室有下列试剂可供选择:![]() 氯水
氯水 ![]()
![]()
![]()
实验小组设计如下实验方案:
试回答:
①试剂为1____ ![]() 填字母
填字母![]() ,写出溶液中发生反应的离子方程式
,写出溶液中发生反应的离子方程式![]() 写出一个即可
写出一个即可![]() ___。
___。
②试剂为2______ ![]() 填字母
填字母![]() 。
。
③固体X的化学式为 ______。
④操作I为 ______。
【题目】剧毒物氰化钠(NaCN)固体遇水或酸生成剧毒易燃的 HCN 气体,同时 HCN 又能与水互溶,造成水污染。已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 |
Ka2=5.6×10-11 |
下列选项错误的是( )
A.向NaCN溶液中通入少量CO2发生的离子反应为2CN-+H2O+CO2=2HCN+![]()
B.相同浓度的 HCOOH和NaCN 的溶液中,水的电离程度前者小
C.中和等体积、等pH 的 HCOOH 溶液和 HCN 溶液消耗 NaOH 的物质的量前者小于后者
D.等体积、等物质的量浓度的 HCOONa 和 NaCN 溶液中所含离子总数前者大于后者
【题目】已知某气态化石燃料X中只含有碳、氢两种元素,为探究该气体中碳和氢两种元素的质量比,某同学设计了燃烧法测量的实验方案,通过测量装置C和D的增重即可求得碳和氢两种元素的质量比.实验装置如下图所示![]() 已知CuO可以作为碳氢化合物燃烧的催化剂
已知CuO可以作为碳氢化合物燃烧的催化剂![]() :
:

(1)若A装置中所盛放的药品是浓NaOH溶液,装置A的作用有:
①______;
②______
(2)D装置中所盛放的药品是______,
(3)E装置的作用是______,
(4)上述装置中有一处缺陷,请改正______.
(5)若实验装置经过改正后,得到的实验数据如下:
质量 | 实验前 | 实验后 |
药品 |
|
|
药品 |
|
|
则该气体中碳和氢两种元素的质量比为______.
【题目】NaCl和NaClO在酸性条件下可发生反应:![]() ,某学习小组拟研究消毒液
,某学习小组拟研究消毒液![]() 主要成分为NaCl和
主要成分为NaCl和![]() 的变质情况.
的变质情况.
(1)此消毒液中NaClO可吸收空气中的![]() 生成
生成![]() 和HClO而变质.写出化学反应方程式:______.
和HClO而变质.写出化学反应方程式:______.
(2)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出.通过以下装置检验气体的成分,从而判断该消毒液是否变质.

限选试剂:![]() 浓硫酸、
浓硫酸、![]() 品红溶液、
品红溶液、![]() 淀粉溶液、
淀粉溶液、![]() 溶液、澄清石灰水、饱和NaCl溶液.
溶液、澄清石灰水、饱和NaCl溶液.
请完成下列实验方案.
所加试剂 | 预期现象和结论 |
向试管A中加足量① ______ ;试管B中加 | 若A中溶液变蓝色,B中溶液不褪色,C中溶液变浑浊,则消毒液部分变质;③ ______ ,则消毒液未变质; ④ ______ ,则消毒液完全变质. |
(3)测定消毒液中NaClO的浓度.实验步骤如下:
①量取![]() 消毒液放入锥形瓶中,加入过量的
消毒液放入锥形瓶中,加入过量的![]() 溶液
溶液![]() .
.
②定量分析.使![]() 的酸性
的酸性![]() 溶液和剩余的
溶液和剩余的![]() 发生反应.重复实验3次,测得平均消耗酸性
发生反应.重复实验3次,测得平均消耗酸性![]() 溶液
溶液![]() ;此过程中涉及的反应有:
;此过程中涉及的反应有:![]() ;
;![]()
③计算.消毒液中NaClO的浓度为______![]() 用含a、b、c、V的代数式表示
用含a、b、c、V的代数式表示![]() .
.