��Ŀ����
������4��Na2S2O3��Һ����Ӧ�����ˮ���ֱ����4��ʢ��20 mL 2 mol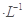 ������ձ��У���ʱ��Na2S2O3��H2SO4�����ؽ��з�Ӧ��
������ձ��У���ʱ��Na2S2O3��H2SO4�����ؽ��з�Ӧ��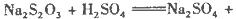
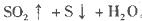 ��������������Ի��ǵ���
��������������Ի��ǵ���
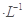 ������ձ��У���ʱ��Na2S2O3��H2SO4�����ؽ��з�Ӧ��
������ձ��У���ʱ��Na2S2O3��H2SO4�����ؽ��з�Ӧ��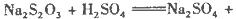
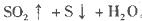 ��������������Ի��ǵ���
��������������Ի��ǵ���A��25 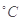 ��20 mL 3 mol ��20 mL 3 mol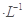 ��Na2S2O3��Һ��25 mL����ˮ ��Na2S2O3��Һ��25 mL����ˮ |
B��0 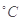 ��30 mL 2 mol ��30 mL 2 mol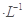 ��Na2S2O3��Һ��15 mL����ˮ ��Na2S2O3��Һ��15 mL����ˮ |
C��25 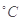 ��10 mL 4 mol ��10 mL 4 mol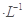 ��Na2S2O3��Һ��35 mL����ˮ ��Na2S2O3��Һ��35 mL����ˮ |
D��0 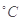 ��10 mL 2mol ��10 mL 2mol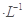 ��Na2S2O3��Һ��35 mL����ˮ ��Na2S2O3��Һ��35 mL����ˮ |
A
������������ȿ���������ζ�ŷ�Ӧ������죬�¶�Խ�ߣ���Ӧ��Ũ��Խ��Ӧ����Խ�졣�Ƚ�4�������A��C���¶Ƚϸߣ��ٱȽ϶����е�Na2S2O3��Һ��Ũ�ȣ���ˮ��A�е�Na2S2O3��Һ��Ũ�Ƚϴ����Է�Ӧ����������A����ѡA��

��ϰ��ϵ�д�
 ��У����ϵ�д�
��У����ϵ�д�
�����Ŀ
 3c(g)�������ʵ�Ũ����ʱ��仯�Ĺ�ϵ��ͼ1��ʾ��������t0��t1��c(B)δ������ͼ2Ϊ��Ӧ��ϵ�з�Ӧ������ʱ��仯���������t2��t3��t4���ı�һ�ֲ�ͬ��������
3c(g)�������ʵ�Ũ����ʱ��仯�Ĺ�ϵ��ͼ1��ʾ��������t0��t1��c(B)δ������ͼ2Ϊ��Ӧ��ϵ�з�Ӧ������ʱ��仯���������t2��t3��t4���ı�һ�ֲ�ͬ��������

 xC(g)+2D(g)����5 min���D��Ũ��Ϊ0.5 mol��L��C��ƽ����Ӧ����Ϊ0.1 mol��(L��min)������
xC(g)+2D(g)����5 min���D��Ũ��Ϊ0.5 mol��L��C��ƽ����Ӧ����Ϊ0.1 mol��(L��min)������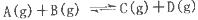 �����е������仯��ͼ��ʾ������˵���������
�����е������仯��ͼ��ʾ������˵���������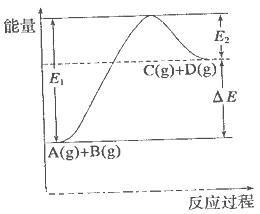

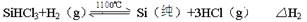
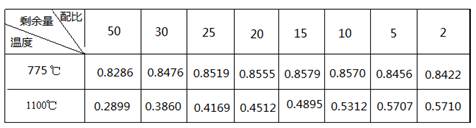
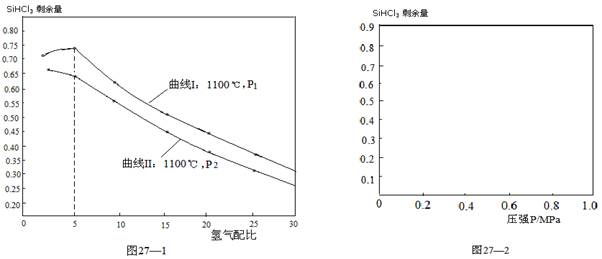
 NaNO3��s��+ClNO��g�� K1 ?H < 0 ��I��
NaNO3��s��+ClNO��g�� K1 ?H < 0 ��I�� 4NO(g)��6HO(g) ��H����Q kJ�� mol��1(Q��0)�������ڲ������ʵ����ʵ���Ũ�����±���
4NO(g)��6HO(g) ��H����Q kJ�� mol��1(Q��0)�������ڲ������ʵ����ʵ���Ũ�����±���