题目内容
100 mL 2 mol/L H2SO4与过量Zn粉反应,在一定温度下,为了加快反应速率,但又不影响生成氢气的总量,可以采取的措施是( )
| A.加入碳酸钠固体 | B.改用18 mol/L的浓H2SO4 |
| C.滴入少量硫酸铜溶液 | D.加入硫酸钾溶液 |
C
试题分析::A、加入碳酸钠固体会和硫酸中的氢离子之间反应生成二氧化碳气体,氢离子浓度减小,速率减慢,且影响生成氢气的量,故A错误;B、改用18mol/L的浓H2SO4,则金属锌和浓硫酸之间反应不会产生氢气,产生的是二氧化硫,故B错误;C、加入少量的CuSO4溶液,锌置换出铜形成铜、锌原电池反应,反应速率增大,且氢气的总量不变,故C正确;D、加入硫酸钾溶液,相当于加入水,体积增大,氢离子的浓度减小,反应速率减慢,故D错误。

练习册系列答案
相关题目
 C+5D反应中,表示该反应速率最快的是( )
C+5D反应中,表示该反应速率最快的是( )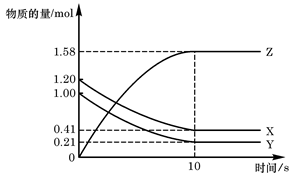
 Z(g)
Z(g) xC(g)+D(g)中,已知:反应开始加入的物质只有A、B;起始浓度A为5 mol·L-1,B为3 mol·L-1,前2 min C的平均反应速率为0.5 mol·L-1·min-1。2 min后,测得D的浓度为0.5 mol·L-1。(设反应前后溶液体积不变)则关于此反应的下列说法中正确的是( )
xC(g)+D(g)中,已知:反应开始加入的物质只有A、B;起始浓度A为5 mol·L-1,B为3 mol·L-1,前2 min C的平均反应速率为0.5 mol·L-1·min-1。2 min后,测得D的浓度为0.5 mol·L-1。(设反应前后溶液体积不变)则关于此反应的下列说法中正确的是( )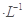 硫酸的烧杯中,此时,Na2S2O3和H2SO4缓慢地进行反应:
硫酸的烧杯中,此时,Na2S2O3和H2SO4缓慢地进行反应: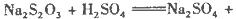
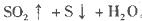 其中最早出现明显浑浊的是
其中最早出现明显浑浊的是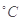 .20 mL 3 mol
.20 mL 3 mol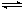 3Z(g) + W(s) ΔH>0 的叙述正确的是
3Z(g) + W(s) ΔH>0 的叙述正确的是