题目内容
在1L密闭容器发生反应:4NH3(g)+5O2(g) 4NO(g)+6HO(g) △H=-Q kJ· mol-1(Q>0),容器内部分物质的物质的量浓度如下表:
4NO(g)+6HO(g) △H=-Q kJ· mol-1(Q>0),容器内部分物质的物质的量浓度如下表:
下列说法错误的是
A.反应在第2min到第4min时,O2的平均速率为0.1875 mol·L-1·min-1
B.反应在第2min时改变了某一条件,该条件可能是使用催化剂或升高温度
C.第4min、第8min时分别达到化学平衡,且平衡常数相同
D.在开始反应的前2min内,该反应放出0.05QKJ的热量
 4NO(g)+6HO(g) △H=-Q kJ· mol-1(Q>0),容器内部分物质的物质的量浓度如下表:
4NO(g)+6HO(g) △H=-Q kJ· mol-1(Q>0),容器内部分物质的物质的量浓度如下表:| 时间/浓度 | c(NH3)( mol·L-1) | c(O2)( mol·L-1) | c(NO)( mol·L-1) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.7 | 1.475 | 0.1 |
| 第10min | 0.7 | 1.475 | 0.1 |
A.反应在第2min到第4min时,O2的平均速率为0.1875 mol·L-1·min-1
B.反应在第2min时改变了某一条件,该条件可能是使用催化剂或升高温度
C.第4min、第8min时分别达到化学平衡,且平衡常数相同
D.在开始反应的前2min内,该反应放出0.05QKJ的热量
C
试题分析:A. 反应在第2min到第4min时V(NH3)=(0.6-0.3)mol/L÷2min=0.15mol/(L·min);V(O2)=" 5/4" V(NH3)= 5/4×0.15mol/(L·min)=0.1875mol/(L·min).正确。B.反应从开始到2min时Δc(NH3)=0.2mol/L,所以根据方程式中与氧气的关系,氧气的浓度改变数值为5/4×0.2mol/L=0.25mol/L。因此a=1.35mol/L.在第2min时改变了某一条件,使反应速率大大加快。改变的条件可能是使用催化剂或升高温度。正确。C.第4min的化学平衡常数
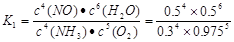 、第8min时达到化学平衡的平衡常数
、第8min时达到化学平衡的平衡常数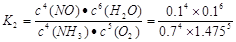 .二者二者数值不相等。错误。D.在开始反应的前2min内,NH3发生反应的物质的量为0.2mol.根据热化学方程式可知:该反应放出0.05QKJ的热量。正确。
.二者二者数值不相等。错误。D.在开始反应的前2min内,NH3发生反应的物质的量为0.2mol.根据热化学方程式可知:该反应放出0.05QKJ的热量。正确。
练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 硫酸的烧杯中,此时,Na2S2O3和H2SO4缓慢地进行反应:
硫酸的烧杯中,此时,Na2S2O3和H2SO4缓慢地进行反应: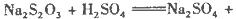
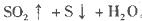 其中最早出现明显浑浊的是
其中最早出现明显浑浊的是 .20 mL 3 mol
.20 mL 3 mol 3Z(g) + W(s) ΔH>0 的叙述正确的是
3Z(g) + W(s) ΔH>0 的叙述正确的是 3Z(g)△H<0, 反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
3Z(g)△H<0, 反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是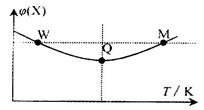
 2SO3(g)体系中,n(SO2)随时间的变化如下表:
2SO3(g)体系中,n(SO2)随时间的变化如下表:
 2C的反应来说,以下化学反应速率的表示中,反应速率最快的是 ( )
2C的反应来说,以下化学反应速率的表示中,反应速率最快的是 ( ) 2C(s)+3D(g) 已知该反应在不同温度下的平衡常数如下表:
2C(s)+3D(g) 已知该反应在不同温度下的平衡常数如下表: Z(g) △H<0,反应经60s达到平衡并生成0.3 mol Z,则下列说法中正确的是
Z(g) △H<0,反应经60s达到平衡并生成0.3 mol Z,则下列说法中正确的是