题目内容
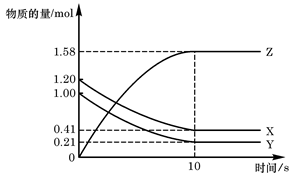
向一体积不变的密闭容器中充入2 mol A、0.6 mol C和一定量的B三种气体,一定条件下发生反应2A(g)+B(g)  3c(g),各物质的浓度随时间变化的关系如图1所示,其中如t0~t1阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况,且t2、t3、t4各改变一种不同的条件。
3c(g),各物质的浓度随时间变化的关系如图1所示,其中如t0~t1阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况,且t2、t3、t4各改变一种不同的条件。

(1)若t1="15" min,则t0~t1阶段以c的浓度变化表示的反应速率V(C)= 。
(2)t3时改变的条件为 ,
B的起始物质的量为 。
(3)t4~t5阶段,若A的物质的量减少了O.01 mol,而此阶段中反应体系吸收能量为a kJ,写出此条件下该反应的热化学方程式: 。
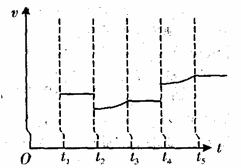
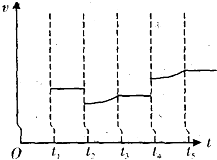
(4)请在如图中定性画出工业合成NH3中H2的逆反应速率(V)随时间(t)变化关系的图像。(其相应的变化特点为:t1达到平衡,t2降温,t3又达到平衡,t4增大压强,t5再次达到平衡。)

 3c(g),各物质的浓度随时间变化的关系如图1所示,其中如t0~t1阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况,且t2、t3、t4各改变一种不同的条件。
3c(g),各物质的浓度随时间变化的关系如图1所示,其中如t0~t1阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况,且t2、t3、t4各改变一种不同的条件。
(1)若t1="15" min,则t0~t1阶段以c的浓度变化表示的反应速率V(C)= 。
(2)t3时改变的条件为 ,
B的起始物质的量为 。
(3)t4~t5阶段,若A的物质的量减少了O.01 mol,而此阶段中反应体系吸收能量为a kJ,写出此条件下该反应的热化学方程式: 。
(4)请在如图中定性画出工业合成NH3中H2的逆反应速率(V)随时间(t)变化关系的图像。(其相应的变化特点为:t1达到平衡,t2降温,t3又达到平衡,t4增大压强,t5再次达到平衡。)

(1)0.02mol/(L?min) (2)减小压强或取出部分平衡混合气体 1.0mol
(3)2A(g)+B(g) 3C(g) ?H="+200a" kJ?mol?1
3C(g) ?H="+200a" kJ?mol?1
(4)
(3)2A(g)+B(g)
 3C(g) ?H="+200a" kJ?mol?1
3C(g) ?H="+200a" kJ?mol?1(4)

试题分析:(1)15min内,以C浓度变化表示的反应速率为v(C)=(0.6—0.3)mol/L÷15min=0.02 mol/(L?min)。
(2)t2~t3和t3~t4这两段平衡是不移动的,则只能是压强和催化剂影响的,因此应该推断该反应为等体积变化的反应,t2~t3的平衡比原平衡的速率要快,而t3~t4的速率又变慢,则前者应是加催化剂,因为条件只能用一次,t3~t4段为减压或取出部分平衡混合气体;反应物的浓度降低,生成物的浓度增大,结合图1可知,A为反应物,C为生成物,A的变化为0.2mol/L,C的变化量为0.3mol/L.又由于该反应为等体积变化的反应,所以B为反应物,根据化学反应的速率之比等于化学方程式前的计量系数比,该反应的方程式为2A(g)+B(g)
 3C(g),所以,△c(B)=1/2△c(A)=1/2×0.2mol/L=0.1mol/L,起始2molA所对应的浓度为1mol/L,则体积应是2mol÷1mol/L=2L,故B的起始物质的量为n(B)=(0.1mol/L+0.4mol/L)×2L=1.0mol。
3C(g),所以,△c(B)=1/2△c(A)=1/2×0.2mol/L=0.1mol/L,起始2molA所对应的浓度为1mol/L,则体积应是2mol÷1mol/L=2L,故B的起始物质的量为n(B)=(0.1mol/L+0.4mol/L)×2L=1.0mol。(3)根据方程式计算,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为a kJ,则反应2molA时,交换热量200akJ,而由图象可知,t4~t5阶段应为升高温度,正反应速率大于逆反应速率,平衡向正反应方向移动,则正反应为吸热反应,所以热化学方程式为2A(g)+B(g)
 3C(g)△H=+200a kJ?mol?1。
3C(g)△H=+200a kJ?mol?1。(4)t1达到平衡,则H2的逆反应速率(V)不变;t2降温,则H2的逆反应速率(V)降低;t3又达到平衡,H2的逆反应速率(V)不变;t4增大压强,H2的逆反应速率(V)增大;t5再次达到平衡,H2的逆反应速率(V)不变,据此画出图象,为
 。
。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 Z(g)
Z(g) xC(g)+D(g)中,已知:反应开始加入的物质只有A、B;起始浓度A为5 mol·L-1,B为3 mol·L-1,前2 min C的平均反应速率为0.5 mol·L-1·min-1。2 min后,测得D的浓度为0.5 mol·L-1。(设反应前后溶液体积不变)则关于此反应的下列说法中正确的是( )
xC(g)+D(g)中,已知:反应开始加入的物质只有A、B;起始浓度A为5 mol·L-1,B为3 mol·L-1,前2 min C的平均反应速率为0.5 mol·L-1·min-1。2 min后,测得D的浓度为0.5 mol·L-1。(设反应前后溶液体积不变)则关于此反应的下列说法中正确的是( )
 2NH3的化学平衡常数K = (保留两位小数)。
2NH3的化学平衡常数K = (保留两位小数)。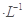 硫酸的烧杯中,此时,Na2S2O3和H2SO4缓慢地进行反应:
硫酸的烧杯中,此时,Na2S2O3和H2SO4缓慢地进行反应: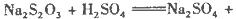
 其中最早出现明显浑浊的是
其中最早出现明显浑浊的是 .20 mL 3 mol
.20 mL 3 mol xC(g)+2D(g),5min后反应达平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L.min).求:
xC(g)+2D(g),5min后反应达平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L.min).求: