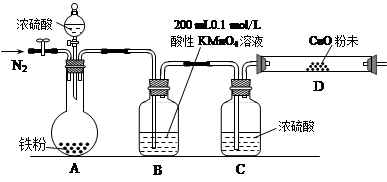
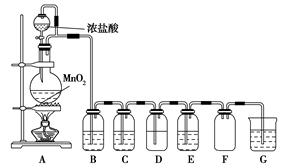
题目内容
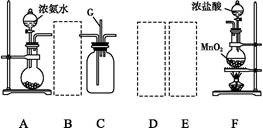
下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。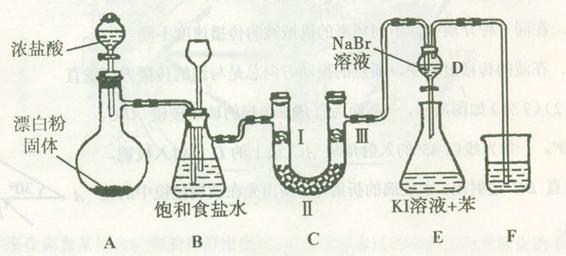
(1)装置A是氯气的发生装置,请写出相应反应的化学方程式: 。
(2)装置B中饱和食盐水的作用是 ;同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象: 。
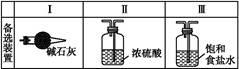
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III处依次放入物质的组合应是 (填字母编号)。
| 编号 | I | II | III |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
| c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是 ,该现象 (填“能”或“不能”)说明溴单质的氧化性强于碘,原因是 。
(5)装置F的作用是 ,其烧杯中的溶液不能选用下列中的 (填字母编号)。
a.饱和NaOH溶液 b.饱和Ca(OH)2溶液
c.饱和Na2SO3溶液 d.饱和Na2CO3溶液
(1)Ca(ClO) 2+4HCl(浓)=CaCl2+2Cl2↑+2H2O
(2)除去Cl2中的HCl B中长颈漏斗中液面上升,形成水柱
(3)d
(4)E中溶液分为两层,上层(苯层)为紫红色 不能 过量的Cl2也可将I-氧化为I2
(5)吸收余氯,防止污染大气 b
解析试题分析:(1)漂白粉中的Ca(ClO)2与浓盐酸反应生成Cl2,化学方程式为:Ca(ClO) 2+4HCl(浓)==CaCl2+2Cl2↑+2H2O
(2)用浓盐酸制取的Cl2中含有HCl,所以装置B中饱和食盐水的作用是除去Cl2中的HCl;如果C中发生堵塞,B中压强增大,则B中长颈漏斗中液面上升,形成水柱。
(3)为了验证氯气是否具有漂白性,I中加入湿润的有色布条,II为U型管,可加入固体干燥剂,得到干燥的Cl2,III中加入干燥的有色布条,即可证明Cl2是否具有漂白性,故d项正确。
(4)装置D中试剂为溴水,加入到E中,Br2与I?反应生成I2,所以实验现象为:E中溶液分为两层,上层(苯层)为紫红色;Cl2通入D与NaBr反应生成Br2,可能会有Cl2剩余,所以把D中溶液加入到E中,也有可能是Cl2将I?氧化为I2,因此不能说明溴单质的氧化性强于碘。
(5)Cl2有毒,需要进行尾气处理,所以装置F的作用是吸收余氯,防止污染大气;A、Cl2能与NaOH溶液反应,被吸收,正确;b、因为Ca(OH)2微溶于水,饱和Ca(OH)2溶液浓度小,不能充分吸收Cl2,错误;C、Cl2具有较强氧化性,能氧化Na2SO3,被吸收,正确;D、Cl2能与Na2CO3溶液反应,生成NaCl、NaClO、NaHCO3,被吸收,正确。
考点:本题考查基本操作、实验方案的设计与分析、化学方程式的书写。

新制氯水中含有多种粒子,某校化学研究性学习小组的同学为探究其性质,做了如下实验,请你帮助完成:
(1)HClO不稳定,见光易分解生成HCl和O2。请设计实验证明有O2生成 。
(2)氯气能使湿润的红色布条退色。对于使湿润的红色布条退色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能。请你设计实验,得出正确结论。
| 提出问题 | 收集资料 | 提出假设 | 验证假设 | 得结论出 |
| 氯水中何种物质能使湿润的红色布条退色? | ①氯气有强氧化性 ②氯气与冷水反应生成盐酸和次氯酸 ③次氯酸有强氧化性 | ① ② ③ ④H2O使布条退色 | ①:实验①:把红色干布条放入充满氯气的集气瓶中,布条不退色 实实验②: ; 实验③:把红色布条放在水里,布条不退色 | |
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如下: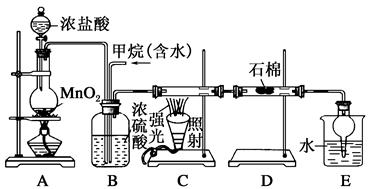
根据设计要求回答:
(1)B装置有三种功能:①控制气流速度;②均匀混合气体;③______________。
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值应________。
(3)D装置的石棉中均匀混有KI粉末,其作用是____________。
(4)E装置的作用是________(填序号)。
| A.收集气体 | B.吸收氯气 |
| C.防止倒吸 | D.吸收氯化氢 |
(6)E装置除生成盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为________。该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为________(填序号)。
a.CH4 b.CH3Cl c.CH2Cl2 d.CHCl3 e.CCl4