题目内容
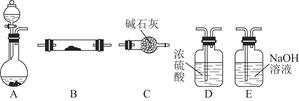
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如下: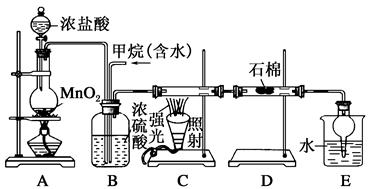
根据设计要求回答:
(1)B装置有三种功能:①控制气流速度;②均匀混合气体;③______________。
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值应________。
(3)D装置的石棉中均匀混有KI粉末,其作用是____________。
(4)E装置的作用是________(填序号)。
| A.收集气体 | B.吸收氯气 |
| C.防止倒吸 | D.吸收氯化氢 |
(6)E装置除生成盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为________。该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为________(填序号)。
a.CH4 b.CH3Cl c.CH2Cl2 d.CHCl3 e.CCl4
(1)干燥混合气体 (2)大于或等于4 (3)吸收过量的氯气 (4)CD (5)CH4+2Cl2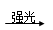 C+4HCl (6)分液 ab
C+4HCl (6)分液 ab
解析

 阅读快车系列答案
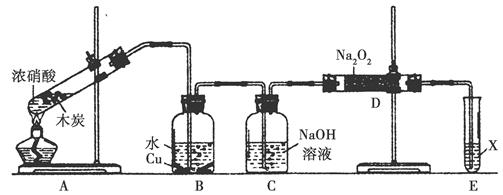
阅读快车系列答案下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。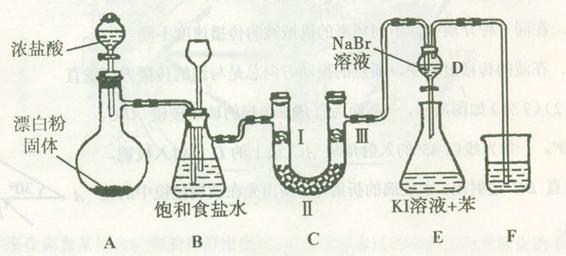
(1)装置A是氯气的发生装置,请写出相应反应的化学方程式: 。
(2)装置B中饱和食盐水的作用是 ;同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象: 。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III处依次放入物质的组合应是 (填字母编号)。
| 编号 | I | II | III |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
| c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是 ,该现象 (填“能”或“不能”)说明溴单质的氧化性强于碘,原因是 。
(5)装置F的作用是 ,其烧杯中的溶液不能选用下列中的 (填字母编号)。
a.饱和NaOH溶液 b.饱和Ca(OH)2溶液
c.饱和Na2SO3溶液 d.饱和Na2CO3溶液
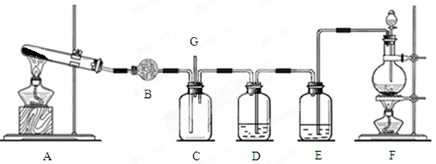
某实验小组同学探究铜与硝酸的反应。
(1)用浓硝酸和水按照不同体积比配成不同浓度的硝酸溶液,各取10 mL硝酸溶液分别与铜片反应,实验记录如下:
| 序号 | 浓硝酸与水的体积比 | 实验现象 |
| Ⅰ | 1:1 | 反应速率快,溶液很快变成蓝色,铜丝表面有大量气泡冒出,气体呈红棕色 |
| Ⅱ | 1:3 | 反应速率较快,溶液变成蓝色,铜丝表面有大量气泡冒出,气体无色 |
| Ⅲ | 1:5 | 反应速率慢,微热后速率加快,溶液变成蓝色,铜丝表面有气泡冒出,气体无色 |
铜与稀硝酸反应的离子方程式为 ;若生成标准状况下0.56 L NO气体,反应中被还原的HNO3的质量为 g(小数点后保留两位有效数字)。
依据上表,制备NO气体最适宜的是实验II,理由是 。
(2)为防止有毒气体逸散造成空气污染,该小组同学改进实验装置,如右图所示(夹持仪器略去)。

用该装置进行铜与稀硝酸的反应并验证产生NO气体的性质,实验步骤如下:
Ⅰ.安装好装置后,检查装置气密性。
Ⅱ.打开旋塞C,从B管上端加入所选浓度的硝酸,至铜丝下沿(不接触铜丝)。
Ⅲ.向上移动B管,使A管液面上升至与橡皮塞恰好接触,关闭旋塞C,反应开始。
Ⅳ.当液面重新下降至与铜丝脱离接触时,反应停止。
Ⅴ.打开旋塞C,向下移动B管,使A中迅速进入少量空气,关闭旋塞C,观察现象。
……
①步骤Ⅰ中检查装置气密性的操作是:关闭旋塞C,从B管上端加入水,若观察到 ,说明装置的气密性良好。
②步骤Ⅲ操作的目的是 。
③为使A管内的NO气体完全被溶液吸收,可进一步采取的操作是 ,能确定NO完全被溶液吸收的现象是 。
化学实验要符合“绿色化学”理念。某实验小组对“铜与浓硝酸反应”进行了探究性实验。试回答下列问题: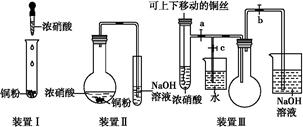
(1)写出铜和浓硝酸反应的离子方程式: 。
(2)与装置Ⅰ相比,装置Ⅱ的优点是 ,装置Ⅲ除具有装置Ⅱ的优点外,还有的优点是 。
(3)在装置Ⅲ中,若使NO2气体充满烧瓶,应先关闭弹簧夹 ,再打开弹簧夹 ;当气体充满烧瓶后,将铜丝提起,然后把a、b、c都关闭,并把烧瓶置于沸水中,下列情况不变的是 。
| A.颜色 |
| B.质量 |
| C.气体的平均相对分子质量 |
| D.密度 |
(4)为了验证NO2与水的反应,欲使烧杯中的水进入烧瓶的操作是 。

 MnCl2+Cl2↑+2H2O。若有6 mol的HCl参加反应,则转移的电子总数为 。
MnCl2+Cl2↑+2H2O。若有6 mol的HCl参加反应,则转移的电子总数为 。