题目内容
(16分)某研究性学习小组为研究铁粉与浓硫酸反应所生成气体的成份并测定各气体的含量,进行了如下实验:【实验推测】足量的铁粉与浓硫酸反应能生成SO2和H2两种气体。
(1)该小组作出此推测的理由是: 。
【实验准备】a.供选择的药品:铁粉、浓硫酸、氧化铜粉末、0.2 mol/L的H2C2O4标准溶液、0.1 mol/L的酸性KMnO4标准溶液、酸碱指示剂。
b.实验装置设计及组装(加热及夹持装置均已略去)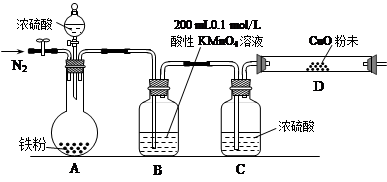
【实验过程及数据处理】
(2)B中发生反应的离子方程式为: 。
(3)实验前先通入一段时间的N2,其目的是 。
(4)B、C、D中所盛试剂均足量,则证实生成的气体中同时存在SO2和H2的现象是
。
(5)A中反应结束后,继续通N2使A中生成的气体全部赶出,待B、D中反应完全后,先后三次取用B中反应后的溶液于锥形瓶中,每次取用25 mL,用H2C2O4标准溶液进行测定。
①H2C2O4标准溶液与酸性KMnO4溶液反应的离子方程式如下,请将该方程式完成并配平。
( )H2C2O4+( )MnO4- +( )H+ =( )Mn2+ +( ) H2O+( ) ( )
②反应完全的现象是 。
③重复测定两次,平均每次耗用H2C2O4标准溶液15.63 mL,则铁与浓硫酸反应产生的SO2气体
的物质的量为 ;经称量,实验前后装置D的质量减少0.8 g,则产生的气体中SO2的体积分数为 。
(16分) (1)在加热的条件下浓硫酸与Fe反应生成SO2,随着反应的进行,硫酸浓度变稀,与Fe反应生成H2
(2) 5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+
(3) 排除装置中的空气,防止H2与空气混合受热发生爆炸。
(4) B瓶中溶液紫红色变浅说明生成了SO2,D中黑色粉末变红说明生成了H2。(答对一种得1分)
(5) ①5、2、6、2、8、10CO2
②滴入最后一滴H2C2O4溶液时KMnO4溶液的紫红色褪去且半分钟之内不恢复。
③0.025 mol, 33.3%
解析试题分析:(1)在加热的条件下浓硫酸与Fe反应生成SO2,随着反应的进行,硫酸浓度变稀,与Fe反应生成H2,所以足量的铁与浓硫酸反应产生的气体可能是二者的混合气体;
(2)B中发生的反应是二氧化硫与酸性高锰酸钾溶液发生的氧化还原反应,离子方程式为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+
(3)实验中产生的氢气与空气混合易发生爆炸,所以实验前先通入一段时间的N2,目的是排除装置中的空气,防止H2与空气混合受热发生爆炸。
(4)二氧化硫与酸性高锰酸钾反应,使溶液颜色变浅或褪色,氢气还原氧化铜有Cu生成,使黑色固体变红,所以实验现象是B瓶中溶液紫红色变浅说明生成了SO2,D中黑色粉末变红说明生成了H2。
(5)①H2C2O4中的C元素是+3价,产物应升高到+4价,所以空白处的产物是CO2,升高2价,MnO4-中的Mn是+7价,产物中的Mn是+2价,降低5价,根据得失电子守恒,可知H2C2O4的系数是5,MnO4-,的系数是2,从而CO2的系数是10,Mn2+,的系数是2,再根据电荷守恒配平H+的系数是6,最后根据质量守恒配平H2O的系数是8;
②高锰酸钾溶液为紫色溶液,当反应完全时滴入最后一滴H2C2O4溶液,KMnO4溶液的紫色褪去且半分钟之内不恢复;
③实验中消耗H2C2O4的物质的量是0.2 mol/L×15.63×10-3L=3.126×10-3mol,则反应后B溶液中的高锰酸钾的物质的量是3.126×10-3mol×2/5×8=0.01mol,所以用于和二氧化硫反应的高锰酸钾的物质的量是0.1mol/L×0.2L-0.01mol=0.01mol,则B中吸收二氧化硫的物质的量是0.01mol×5/2=0.025mol;
根据D中的固体的质量的减少值,可计算氢气的物质的量。
CuO+H2=Cu+H2O, 固体质量减少
1mol 16g
n 0.8g
解得n=0.05mol,
所以混合气体中有0.025mol的SO2和0.05mol的H2,实验后二氧化硫的体积分数也是物质的量分数是0.025/(0.025+0.05) ×100%=33.3%.
考点:考查铁与浓硫酸的反应实验,气体的检验,氧化还原反应的计算,离子方程式的书写与配平,实验现象的判断,对实验的分析

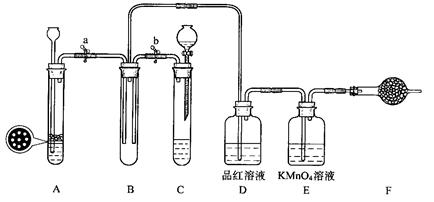
某小组同学用下图装置进行实验研究(a、b、c表示止水夹).请评价或完善其方案:
将装置A、C、E相连接,用MnO2和浓盐酸制取氯气,请回答:
①.氯元素在周期表中的位置为 。
②.A中反应的离子方程式:___ _。
③.E中氢氧化钠溶液的作用__________ 。
在C中加入适量的水可制得氯水.将所得氯水分成两份进行实验,其操作、现象和结论为:
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 品红溶液褪色 | 氯气有漂白性 |
| Ⅱ | 氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应的产物具有酸性 |
⑤.实验Ⅱ推出相应的结论是否合理?_________,若不合理,请说明理由(若合理,无需填写)____________________________________ ____________________。
(2) 为比较Cl2和I2的氧化性强弱,将A、C、E相连, C中盛的试剂可以为___ _ __。
(3) 将B、D、E相连,在B中装浓硝酸和铜片,可制得NO2并进行有关实验.
①.B中反应的化学方程式_____________________ ______ __________。
②.先若关闭c,当丁中充满红棕色的NO2时,再关闭止水夹a、b,微热试管丁, 丁中可观察到的实验现象 。
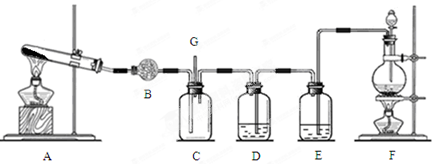
为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验Ⅰ:反应产物的定性探究。
实验装置如图所示:(固定装置已略去)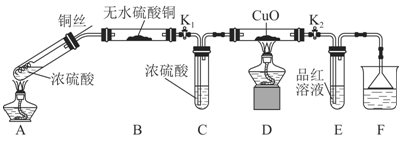
(1)A中反应的化学方程式为 。
(2)F烧杯中的溶液通常是 。
(3)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是
。
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 。
(5)为说明浓硫酸中的水是否影响B装置现象的判断,还须进行一次实验。实验方案为 。
实验Ⅱ:反应产物的定量探究
(6)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料。
资料1:
| 硫酸/mol·L-1 | 黑色物质出现的温度/℃ | 黑色物质消失的温度/℃ |
| 15 | 约150 | 约236 |
| 16 | 约140 | 约250 |
| 18 | 约120 | 不消失 |
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度≥15 mol/L
d.硫酸浓度越大,黑色物质越快出现、越难消失
(7)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00 mL加入足量KI溶液振荡,以淀粉溶液为指示剂,用b mol/L Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液V mL。若反应消耗铜的质量为a g,则硫酸铜的产率为 _。(已知:2Cu2++4I-===2CuI+I2,2S2O
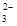 +I2===S4O
+I2===S4O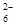 +2I-)
+2I-) 下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。
(1)装置A是氯气的发生装置,请写出相应反应的化学方程式: 。
(2)装置B中饱和食盐水的作用是 ;同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象: 。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III处依次放入物质的组合应是 (填字母编号)。
| 编号 | I | II | III |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
| c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是 ,该现象 (填“能”或“不能”)说明溴单质的氧化性强于碘,原因是 。
(5)装置F的作用是 ,其烧杯中的溶液不能选用下列中的 (填字母编号)。
a.饱和NaOH溶液 b.饱和Ca(OH)2溶液
c.饱和Na2SO3溶液 d.饱和Na2CO3溶液