题目内容
一种新催化剂,能在室温下催化空气氧化甲醛:HCHO+O2 CO2+H2O,该反应
CO2+H2O,该反应
| A.反应物和生成物中都含极性分子和非极性分子 |
| B.生成1.8gH2O消耗2.24L O2 |
| C.反应时有极性键和非极性键的断裂和它们的生成 |
| D.为吸热反应 |
A
解析试题分析:A中HCHO和 H2O是极性分子,CO2和O2是非极性分子,正确;B没有说明是标况,无法判断,错误;C.反应时有极性键和非极性键的断裂,但没有非极性键的生成,错误;D有机物的氧化反应为放热反应,错误;
考点:本题主要考查微粒的构成和微粒间的作用力。

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
下列变化需克服相同类型作用力的是( )
| A.碘和干冰的升华 | B.硅和C60的熔化 |
| C.氯化氢和氯化钾的溶解 | D.溴和汞的气化 |
下列说法正确的是
| A.NH4Cl为共价化合物 |
| B.N2分子中含有一对共用电子对 |
| C.Na2O2既含有离子键又含有非极性键 |
| D.电解水与电解熔融NaCl时破坏的化学键类型相同 |
氯化钠是日常生活中人们常用的调味品,下列性质可以证明氯化钠中一定存在离子键的是
| A.具有较高的熔点 | B.熔融状态下能导电 |
| C.水溶液能导电 | D.常温下能溶于水 |
下图中每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是( )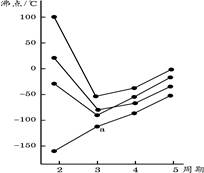
| A.H2S | B.HCl | C.PH3 | D.SiH4 |
下列各组物质中,所有化学键都是共价键的是( )。
| A.H2S和Na2O2 | B.H2O2和CaF2 |
| C.NH3和N2 | D.HNO3和NaCl |
用VSEPR模型预测下列分子或离子的立体结构,其中不正确的是( )
| A.NH4+为正四面体形 | B.CS2为直线形 |
| C.HCN为折线形(V形) | D.PCl3为三角锥形 |
NH3、H2O等是极性分子,CO2、BF3、CCl4等是极性键构成的非极性分子。根据上述事实可推ABn型分子是非极性分子的经验规律是( )
| A.在ABn分子中A原子的所有价电子都参与成键 |
| B.在ABn分子中A的相对原子质量应小于B的相对原子质量 |
| C.在ABn分子中每个共价键的键长都相等 |
| D.分子中不能含有氢原子 |
固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的电子层结构,电子式如图所示: ,下列说法正确的是( )
,下列说法正确的是( )
| A.NH5属于离子化合物 | B.NH5属于共价化合物 |
| C.NH5只含有离子键 | D.NH5只含有共价键 |