题目内容
氯化钠是日常生活中人们常用的调味品,下列性质可以证明氯化钠中一定存在离子键的是
| A.具有较高的熔点 | B.熔融状态下能导电 |
| C.水溶液能导电 | D.常温下能溶于水 |
B
解析试题分析:A、原子晶体也具有较高的熔点,但原子晶体中含有共价键,因此A不正确;B、共价键在熔融状态下不能电离出离子,因此不能导电。而离子键在熔融状态下可以电离出离子,能导电,据此可以判断是含有离子键,还是含有共价键,B正确;C、氯化氢溶于水也导电,但氯化氢中含有共价键,C不正确;D、常温下能溶于水不能作为判断的依据,例如氯化氢、氨气等极易溶于水,但含有共价键。碳酸钙难溶于水,但含有离子键,D不正确,答案选B。
考点:考查离子键与共价键的判断

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
一种新催化剂,能在室温下催化空气氧化甲醛:HCHO+O2 CO2+H2O,该反应
CO2+H2O,该反应
| A.反应物和生成物中都含极性分子和非极性分子 |
| B.生成1.8gH2O消耗2.24L O2 |
| C.反应时有极性键和非极性键的断裂和它们的生成 |
| D.为吸热反应 |
硼及其化合物在催化剂制造、储氢材料、燃料电池等方面应用广泛。Li3BN2是一种价格低廉且性能优良的储氢材料,其储氢与放氢原理为Li3BN2+4H2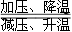 Li3BN2H8。下列有关说法正确的是
Li3BN2H8。下列有关说法正确的是
| A.B的原子半径小于N的原子半径 |
| B.H2的结构式为H—H |
| C.放氢过程为化合反应 |
| D.储氢过程没有能量变化 |
下列选项的说法中正确的是
| A.分子的结构是由键角决定的 |
| B.共价键的键能越大,共价键越牢固 |
| C.CF4、CCl4、CBr4、CI4中C—X键的键长、键角均相等 |
| D.H2O分子中的两个O—H键的键角为180° |
下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是
| A.SO2和SiO2 | B.CCl4和KCl | C.NaCl和HCl | D.CO2和H2O |
2004年7月德俄两国化学家共同宣布,在高压下氮气会发生聚合得到高聚氮,这种高聚氮的N-N键的键能为160kJ/mol(N2的键能为942kJ/mol),晶体片段结构如图所示。又发现从N2可制取出N5、N3。含N5+离子的化合物及N60、N5极不稳定。则下列说法错误的是:
| A.该晶体中含有非极性共价键 |
| B.含N5+离子的化合物中既有离子键又有共价键 |
| C.高聚氮与N2、N3、N5、N5+、N60互为同素异形体 |
| D.这种固体的可能潜在应用是烈性炸药或高能材料 |
下列物质中,既有离子键,又有共价键的是
| A.HCl | B.KOH | C.CaCl2 | D.CH3COOH |
下列有关离子键和离子化合物的说法正确的是( )
| A.凡含离子键的化合物,一定含金属元素 |
| B.在化合物MgCl2中,两个氯离子之间也存在离子键 |
| C.离子化合物一定能导电 |
| D.原子序数为11与9的元素能够形成离子化合物,该化合物中存在离子键 |