题目内容
把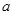 L含硫酸铵、硝酸铵的混合溶液分成两等份,一份用
L含硫酸铵、硝酸铵的混合溶液分成两等份,一份用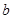 mol烧碱刚好把NH3全部赶出,另一份与氯化钡溶液完全反应消耗
mol烧碱刚好把NH3全部赶出,另一份与氯化钡溶液完全反应消耗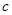 molBaCl2,则原溶液中
molBaCl2,则原溶液中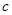 (NO
(NO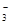 )为( )
)为( )
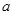 L含硫酸铵、硝酸铵的混合溶液分成两等份,一份用
L含硫酸铵、硝酸铵的混合溶液分成两等份,一份用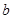 mol烧碱刚好把NH3全部赶出,另一份与氯化钡溶液完全反应消耗
mol烧碱刚好把NH3全部赶出,另一份与氯化钡溶液完全反应消耗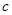 molBaCl2,则原溶液中
molBaCl2,则原溶液中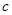 (NO
(NO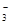 )为( )
)为( )A.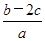 mol·L-1 mol·L-1 | B.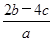 mol·1-1 mol·1-1 |
C.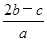 mol·L-1 mol·L-1 | D.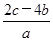 mol·L-1 mol·L-1 |
B
一份用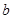 mol烧碱刚好把NH3全部赶出,说明每份溶液中含有的NH4+是bmol。另一份与氯化钡溶液完全反应消耗
mol烧碱刚好把NH3全部赶出,说明每份溶液中含有的NH4+是bmol。另一份与氯化钡溶液完全反应消耗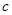 molBaCl2,说明每份溶液中含有SO42-是cmol,根据原子守恒可知每份溶液中硝酸铵是(b-2c)mol,所以原溶液中
molBaCl2,说明每份溶液中含有SO42-是cmol,根据原子守恒可知每份溶液中硝酸铵是(b-2c)mol,所以原溶液中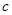 (NO
(NO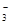 )为
)为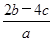 mol·1-1。答案是B。
mol·1-1。答案是B。
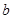 mol烧碱刚好把NH3全部赶出,说明每份溶液中含有的NH4+是bmol。另一份与氯化钡溶液完全反应消耗
mol烧碱刚好把NH3全部赶出,说明每份溶液中含有的NH4+是bmol。另一份与氯化钡溶液完全反应消耗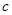 molBaCl2,说明每份溶液中含有SO42-是cmol,根据原子守恒可知每份溶液中硝酸铵是(b-2c)mol,所以原溶液中
molBaCl2,说明每份溶液中含有SO42-是cmol,根据原子守恒可知每份溶液中硝酸铵是(b-2c)mol,所以原溶液中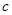 (NO
(NO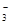 )为
)为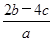 mol·1-1。答案是B。
mol·1-1。答案是B。
练习册系列答案
相关题目
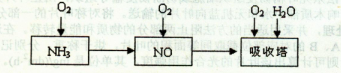
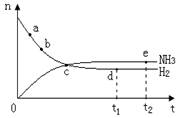
 2NH3,该反应在固定容积的密闭容器中进行。
2NH3,该反应在固定容积的密闭容器中进行。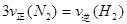
 2NH3(g) ;△H< 0 。 400℃、30MPa下n(NH3)和n(H2)随时间变化的关系如图,下列叙述错误的是( )
2NH3(g) ;△H< 0 。 400℃、30MPa下n(NH3)和n(H2)随时间变化的关系如图,下列叙述错误的是( )