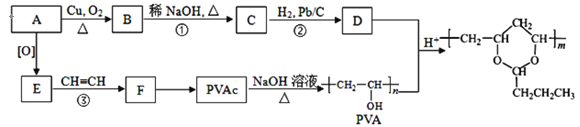
题目内容
【题目】电化学与我们的生活有着密切的联系,请结合电化学知识回答下列有关问题:
(1)炒过菜的铁锅未及时洗浄(残液中含NaCl),不久便会因腐蚀而出现红褐色锈斑。试回答:铁锅的锈蚀应属于____________(填“析氢腐蚀”或“吸氧腐蚀”), 铁锅锈蚀的正极反应式为:____________。
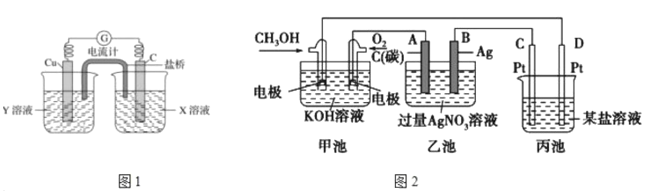
(2)利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如上图1所示原电池,回答下列问题:
①写出正极电极反应式___________
②图中X溶液中的溶质是____________
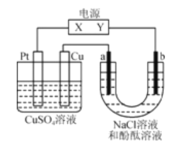
(3)如图2是一个电化学反应的示意图。
①写出通入CH3OH的电极的电极反应式_______________
②乙池中总反应的离子方程式_____________
③熔融盐CH3OH燃料电池用熔融碳酸钾为电解质,则电池负极反应式__________
④当乙池中B(Ag)极的质量增加5.40g,若此时乙池中溶液的体积为500ml,则溶液H+的浓度是_____________;此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是_____(填序号)。
A. MgSO4 B. CuSO4 C. NaCl D. AgNO3
【答案】吸氧腐蚀 O2+2H2O+4e-=4OH- 2Fe3++2e-=2Fe2+ FeCl3 CH3OH-6e-+80H-=CO32-+6H2 O 4Ag++2H2O=4Ag+O2↑+4H+ CH3OH-6e-+3CO32-=4CO2+2H2O 0.1 BD
【解析】
(1)铁锅中含有Fe、C,Fe、C和电解质溶液构成原电池,该原电池中,Fe易失电子作负极、C作正极,负极上铁失电子生成亚铁离子,正极上氧气得电子发生还原反应,负极反应式为Fe-2e-=Fe2+、正极反应式为O2+2H2O+4e-=40H-,亚铁离子和氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁不稳定,被氧气氧化生成氢氧化铁;
(2)C为正极,发生还原反应,电极方程式为2Fe3++2e-=2Fe2+,Cu为负极,电极方程式为Cu-2e-=Cu2+;由装置图可知知Y是氯化铜溶液,电解质溶液X是FeCl3;
(3)①燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极,甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O;
②电解硝酸银溶液时,银离子得电子生成银、水失电子生成氧气和氢离子,离子方程式为4Ag++2H2O=4Ag+O2↑+4H+;
③熔融盐CH3OH燃料电池用熔融碳酸钾为电解质,则电池负极上甲醇失电子与碳酸根离子反应生成二氧化碳,电极反应式为CH3OH-6e-+3CO32-=4CO2+2H2O
④当乙池中B(Ag)极的质量增加5.40g时,设氢离子浓度为 amol/L,
4Ag++2H2O=4Ag+O2↑+4H+
432g 4mol
5.40g 0.5amol
解得:a=0.1
阴极上析出金属,则在金属活动性顺序表中金属元素处于H元素后,根据串联电池中转移电子数相等知,丙中析出金属元素需要的电子等于或小于乙池中转移电子数,据此确定含有的金属元素,析出5.40g时转移电子数是0.05mol。
A.硫酸镁中镁元素处于H元素之前,所以阴极上不析出金属单质,选项A错误
B.电解硫酸铜溶液时,阴极上析出1.60g铜需要转移电子0.05mol,选项B正确;
C.NaCl中钠元素处于氢元素前,所以阴极上不析出金属单质,选项C错误;
D.电解硝酸银溶液时,阴极上析出1.60g银需要转移电子0.0148mol<0.05mol,选项D正确。
答案为:BD。

 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案