题目内容
5.已知:2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-12CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1 452kJ•mol-1
H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
下列说法正确的是( )
| A. | H2(g)的燃烧热为571.6 kJ•mol-1 | |
| B. | $\frac{1}{2}$H2SO4(aq)+$\frac{1}{2}$Ba(OH)2(aq)═$\frac{1}{2}$BaSO4(s)+H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 | |
| D. | 3H2(g)+CO2(g)═CH3OH(l)+H2O(l)△H=+131.4 kJ•mol-1 |
分析 A、依据燃烧热概念 是1mol可燃物完全燃烧生成稳定氧化物放出的热量分析;
B、酸碱中和反应生成的硫酸钡过程中放热;
C、依据热化学方程式计算比较;
D、依据热化学方程式和盖斯定律计算分析判断.
解答 解:A、依据燃烧热概念分析,选项中由已知热化学方程式计算可知H2(g)的燃烧热为285.8 kJ•mol-1,故A错误;
B、反应中有BaSO4(s)生成,而生成BaSO4也是放热的,所以放出的热量比57.3 kJ多,即B项中△H<-57.3 kJ•mol-1,故B错误;
C、同质量的H2(g)和CH3OH(l)完全燃烧,设质量为1g
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
2 571.6KJ
$\frac{1}{2}$mol 142.9KJ
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1 452kJ•mol-1
2 1452KJ
$\frac{1}{32}$mol 22.69KJ
所以H2(g)放出的热量多,故C正确;
D、①2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
②2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1 452kJ•mol-1
按盖斯定律计算①×3-②得到6H2(g)+2CO2(g)═2CH3OH(l)+2H2O(l)△H=-262.8 kJ•mol-1.
可知正确的是3H2(g)+CO2(g)═CH3OH(l)+H2O(l)△H=-131.4 kJ•mol-1,故D错误;
故选C.
点评 本题考查了热化学方程式和盖斯定律计算应用,燃烧热,中和热概念的理解应用是解题关键,题目难度中等.

 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案| A. | 12553I 原子核内中子数为53 | |
| B. | 12553I原子核外电子数为72 | |
| C. | 12553I 和12753I互为同位素 | |
| D. | 12553I代表有53个质子和125个中子的碘原子 |
| A. | 合成氨工厂通常采用20 MPa~50 MPa压强,以提高原料的利用率 | |
| B. | 合成氨工业中使反应温度达到500℃有利于氨的合成 | |
| C. | 合成三氧化硫过程中使用过量的氧气,以提高二氧化硫的转化率 | |
| D. | 阴暗处密封有利于氯水的储存 |
| A. | 常温常压下,11.2 L Cl2所含有的原子数目为NA | |
| B. | 9克 H2O所含有的氢原子数目为NA | |
| C. | 在同温同压时,1mol任何气体的体积都相同且均约为22.4L | |
| D. | 0.1 molCH4分子含有的原子数目为 NA |
| A. | 若体积相等,则密度相等 | B. | 若质量相等,则质子数相等 | ||
| C. | 若分子数相等,则体积相等 | D. | 若原子数相等,则电子数相等 |
| A. | 活化分子具有的能量比普通分子的能量高 | |
| B. | 发生有效碰撞的分子必为活化分子 | |
| C. | 活化分子之间的碰撞一定都是有效碰撞 | |
| D. | 活化分子数目越多,反应速率一定会变快 |
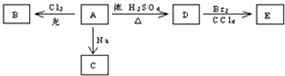 化合物A(C4H10O)是一种有机溶剂.A可以发生如图变化:
化合物A(C4H10O)是一种有机溶剂.A可以发生如图变化: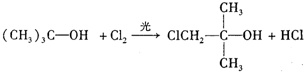 .
. .
.