题目内容
15.下列有关活化分子的说法中正确的是( )| A. | 活化分子具有的能量比普通分子的能量高 | |
| B. | 发生有效碰撞的分子必为活化分子 | |
| C. | 活化分子之间的碰撞一定都是有效碰撞 | |
| D. | 活化分子数目越多,反应速率一定会变快 |
分析 A、能够发生有效碰撞的分子是活化分子,活化分子具有较高能量;
B、发生有效碰撞的分子,为活化分子;
C、当发生化学反应的碰撞才是有效碰撞;
D、单位体积活化分子的数目越多,则反应速率越快;
解答 解:A、能够发生有效碰撞的分子是活化分子,活化分子具有比普通分子更高的能量,故A正确;
B、发生有效碰撞的分子,为活化分子,故B正确;
C、活化分子之间的碰撞不一定为有效碰撞,当发生化学反应的碰撞才是有效碰撞,故C错误;
D、活化分子的百分数越高,化学反应速率越快,化学反应中,物质含有的活化分子数目多,不代表活化分子的百分数高,故D错误;
故选AB.
点评 本题考查活化能及其对反应速率的影响,题目难度不大,注意活化分子、有效碰撞以及活化能等概念的理解.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目
5.已知:2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1 452kJ•mol-1
H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
下列说法正确的是( )
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1 452kJ•mol-1
H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
下列说法正确的是( )
| A. | H2(g)的燃烧热为571.6 kJ•mol-1 | |
| B. | $\frac{1}{2}$H2SO4(aq)+$\frac{1}{2}$Ba(OH)2(aq)═$\frac{1}{2}$BaSO4(s)+H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 | |
| D. | 3H2(g)+CO2(g)═CH3OH(l)+H2O(l)△H=+131.4 kJ•mol-1 |
6.下列关于氯气的说法正确的是( )
| A. | 氯气易液化,可储存于钢瓶中 | |
| B. | 实验室可以用向下排空气法收集氯气 | |
| C. | 氯气不能将碘化钾中的碘置换出来 | |
| D. | 氯气的摩尔质量为71g |
3.下列事实不能用勒夏特列原理解释的是( )
| A. | 工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率 | |
| B. | 合成氨工厂通常采用20MPa~50MPa压强,以提高原料的利用率 | |
| C. | 实验室用排饱和食盐水的方法收集氯气 | |
| D. | 用铁触媒作催化剂加快化学反应速率 |
10.下列物质中,属于强电解质的是( )
| A. | CH3COOH | B. | H2O | C. | NH3•H2O | D. | NaOH |
20.下列说法中不正确的是( )
| A. | 构成原电池的正极和负极不一定是两种不同的金属 | |
| B. | 用铁棒作阳极、碳棒作阴极电解饱和氯化钠溶液的离子方程式为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 可逆反应2SO2+O2?2SO3的平衡状态下,保持恒温恒容向容器中加入一定量的O2,Qc变小,K不变,O2转化率减小 | |
| D. | 如果△H和△S均为正值,当高温时,反应可能自发进行 |
4.下列物质在水溶液中能够全部电离的是( )
| A. | H2O | B. | NH3•H2O | C. | CH3COONH4 | D. | CH3COOH |
10.下列各项叙述中,正确的是( )
| A. | N、P、As的电负性随原子序数的增大而增大 | |
| B. | 价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素 | |
| C. | 2p和3p轨道形状均为哑铃形,能量也相等 | |
| D. | 镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态 |
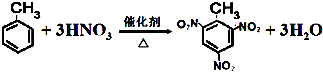
 .
.