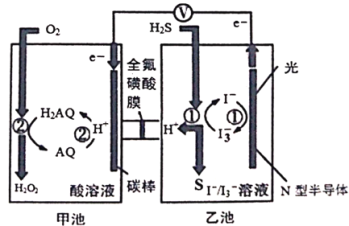
题目内容
【题目】CO2的资源化利用能有效减少CO2的排放,充分利用碳资源。
(1)全球变暖现象很可能是大气中的温室气体(如CO2)聚集造成的。有科学家提出可以将CO2通过管道输送到海底,这样可减缓空气中CO2浓度的增加。下列有关说法正确的是______(填字母)。
A 送到海底越深的地方,CO2溶解得越多,同时CO2可能液化甚至变成干冰
B 把CO2输送到海底,会使海水酸性增强,有利于海洋生态环境
C 把CO2输送到海底,这是人类减缓空气中CO2浓度增加速率的唯一办法
D 要减缓空气中CO2浓度的增加,最有效的措施是使用新能源和植树造林
(2)已知:
①CH4(g)+2O2(g)![]() CO2(g)+2H2O(l) △H=-890 kJ· mol-1
CO2(g)+2H2O(l) △H=-890 kJ· mol-1
②2H2(g)+O2(g)![]() 2H2O(l) △H=-572 kJ· mol-1
2H2O(l) △H=-572 kJ· mol-1
则反应CO2(g)+4H2(g)![]() CH4(g)+2H2O(l) △H=______kJ· mol-1,升高温度,该反应的v(逆)__________(填“增大”或“减小”)。
CH4(g)+2H2O(l) △H=______kJ· mol-1,升高温度,该反应的v(逆)__________(填“增大”或“减小”)。
(3)CO2催化加氢合成二甲醚是CO2转化的-种方法,主要发生下列反应:
反应I:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H=+41.2 kJ· mol-1
CO(g)+H2O(g) △H=+41.2 kJ· mol-1
反应II:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H=-122.5 kJ· mol-1
CH3OCH3(g)+3H2O(g) △H=-122.5 kJ· mol-1
在一体积为1 L的恒容密闭容器中,充入1 mol CO2与1 mol H2,CO2的平衡转化率和平衡时CH3OCH3的选择性随温度的变化曲线如图所示。其中:CH3OCH3的选择性=![]() ×100%。
×100%。
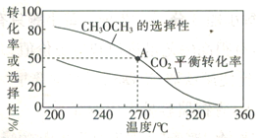
①CH3OCH3的选择性随温度的升高而降低的原因是___________,温度高于300℃时,CO2的平衡转化率随温度的升高而增大的原因是____________。
②270°C时,测得平衡时CH3OCH3的物质的量为0.1 mol,此时n(H2O)=_________mol,反应I的化学平衡常数K=___________(保留两位有效数字)。
(4)多晶Cu是目前唯一被实验证实能高效催化CO2还原为烃类(如C2H4)的金属。电解装置中分别以多晶Cu和铂为电极材料,用阴离子交换膜分隔开阴、阳极室,阴、阳极室的KHCO3溶液的浓度(约0.1 mol·L-1左右)基本保持不变。并向某极室内持续通入CO2,温度控制在10℃左右。通入CO2的电极为__________(填“阴极”或“阳极”),生成C2H4的电极反应式为_____________。
【答案】A、B、D -254 增大 生成CH3OCH3的反应反应Ⅱ的ΔH<0,为放热反应,温度越高,平衡左移,导致生成CH3OCH3的物质的量减少,虽然该反应消耗的CO2减少,但反应Ⅰ的ΔH>0,为吸热反应,温度升高平衡右移,消耗的CO2增多,总消耗的CO2的量变化不大 反应Ⅰ的ΔH>0,反应Ⅱ的ΔH<0,温度升高使CO2转化为CO的平衡转化率上升,使CO2转化为CH3OCH3的平衡转化率下降,且上升幅度超过下降幅度 0.5 0.87 阴极 ![]()
【解析】
(1)根据二氧化碳气体的性质,分析处理二氧化碳气体的可能的方法;
(2)根据盖斯定律来计算目标反应方程式的ΔH;升高温度会同时增大正逆反应速率,平衡会发生移动是因为正逆反应速率增大的幅度不同。
(3)①CH3OCH3的选择性=![]() ×100%,选择性的决定因素为生成的CH3OCH3的量和消耗的CO2的量,分析温度变化会时这两个量如何变化即选择性变化的原因;CO2的平衡转化率是由两个反应共同决定,所以要从温度变化时两个反应分别如何移动的角度去分析;
×100%,选择性的决定因素为生成的CH3OCH3的量和消耗的CO2的量,分析温度变化会时这两个量如何变化即选择性变化的原因;CO2的平衡转化率是由两个反应共同决定,所以要从温度变化时两个反应分别如何移动的角度去分析;
②已知生成的CH3OCH3的量,通过选择性的求算公式可知消耗的CO2的量,但要注意是两个反应共同消耗的CO2的量,之后根据物质之间转化时的数量关系即可求解水的物质的量;平衡常数![]() 据此求解;
据此求解;
(4)电解池中阴极得电子发生还原反应,阳极失电子发生氧化反应,通过CO2在反应中的化合价降低可知其为阴极;根据题目信息可知生成C2H4的电极为通入CO2的电极,电解池中阴离子会流向阳极,而该过程中用阴离子交换膜分隔开阴、阳极室,阴、阳极室的KHCO3溶液的浓度基本保持不变,可推测阴极有碳酸氢根生成,再结合电子守恒和元素守恒可得电极反应方程式。
(1)A海底越深的地方压强越大,CO2溶解得越多,同时CO2可能液化甚至变成干冰,故A项正确;
B.二氧化碳与水反应生成碳酸,溶液呈酸性,会使海水酸性增强,破坏海洋生态环境,故B正确;
C.减缓空气中CO2浓度的方法有多种,如合成聚二氧化碳塑料等,故C错误;
D.使用新能源,可减少二氧化碳的排放,植树造林,可降低二氧化碳的浓度,故D正确.
故答案为:A、B、D;
(2)根据盖斯定律可知目标反应方程式=②×2-①,故△H=-572×2-(-890)=-254 kJ· mol-1;升高温度正逆反应速率都增大,故答案为:-254;增大;
(3)①CH3OCH3的选择性=![]() ×100%,生成CH3OCH3的反应反应Ⅱ的ΔH<0,为放热反应,温度越高,平衡左移,导致生成CH3OCH3的物质的量减少,虽然该反应消耗的CO2减少,但反应Ⅰ的ΔH>0,为吸热反应,温度升高平衡右移,消耗的CO2增多,故CH3OCH3的选择性下降;
×100%,生成CH3OCH3的反应反应Ⅱ的ΔH<0,为放热反应,温度越高,平衡左移,导致生成CH3OCH3的物质的量减少,虽然该反应消耗的CO2减少,但反应Ⅰ的ΔH>0,为吸热反应,温度升高平衡右移,消耗的CO2增多,故CH3OCH3的选择性下降;
反应Ⅰ的ΔH>0,反应Ⅱ的ΔH<0,温度升高使CO2转化为CO的平衡转化率上升,使CO2转化为CH3OCH3的平衡转化率下降,且上升幅度超过下降幅度,故温度高于300℃时,CO2的平衡转化率随温度的升高而增大;
②270°C时,CH3OCH3的选择性为50%,CH3OCH3的物质的量为0.1 mol,根据其计算公式可知反应消耗的CO2为0.4mol,根据方程式![]() ,可知该反应中消耗的CO2为0.2mol,消耗的H2为0.6mol,生成的H2O为0.3mol,共消耗CO2为0.4mol,所以反应
,可知该反应中消耗的CO2为0.2mol,消耗的H2为0.6mol,生成的H2O为0.3mol,共消耗CO2为0.4mol,所以反应![]() 中消耗的CO2为0.4-0.2=0.2mol,消耗的H2为0.2mol生成的H2O为0.2mol,生成的CO为0.2mol,所以此时n(H2O)=0.3+0.2=0.5mol;反应I的化学平衡常数
中消耗的CO2为0.4-0.2=0.2mol,消耗的H2为0.2mol生成的H2O为0.2mol,生成的CO为0.2mol,所以此时n(H2O)=0.3+0.2=0.5mol;反应I的化学平衡常数![]() ,容器的体积为1L,此时容器中CO2的浓度为
,容器的体积为1L,此时容器中CO2的浓度为![]() ,CO的浓度为
,CO的浓度为![]() ,H2O的浓度为
,H2O的浓度为![]() ,所以平衡常数
,所以平衡常数![]() ,故答案为:0.5;0.87;
,故答案为:0.5;0.87;
(4)该过程中CO2经反应后生成C2H4,C元素化合价降低,被还原,还原反应发生在阴极,故通入CO2的电极为阴极;阴离子会流向阳极,而该过程中用阴离子交换膜分隔开阴、阳极室,阴、阳极室的KHCO3溶液的浓度基本保持不变,可推测阴极有碳酸氢根生成,故电极反应方程式为![]() ,故答案为:阴极;
,故答案为:阴极;![]() 。
。

【题目】化学与人类生活密切相关。请按要求,回答下列问题:
(1)春秋末期工艺官书《考工记》中记载有“涑帛”的方法,即利用含有碳酸钠的水溶液来洗涤丝帛。请写出碳酸钠水溶液中通入CO2气体的化学方程式____,将54.8g Na2CO3和NaHCO3 的混合物分成等量的两份,一份溶于水后加入足量盐酸,收集到气体V L,另一份直接加热至恒重,生成气体2.24L(所有气体体积均在标准状况下测定),则原固体混合物中Na2CO3的物质的量:n(Na2CO3)=____,气体V=____。
(2)“84”消毒液在生活中使用广泛,其有效成分是次氯酸钠。可在常温下将氯气通入NaOH溶液制得,该反应的离子方程式为____,若有2mol氯气参与该反应,则此时转移的电子数为____NA。
(3)小苏打可用于治疗胃酸过多,其反应的离子方程式为____。
(4)长石是地表岩石最重要的造岩矿物。某种长石的化学组成KAlSi3O8则将其改写成氧化物的组合形式为____。
(5)葡萄糖(分子式C6H12O6)是人体活细胞的能量来源。已知1mol等于1000mmol,某体检单的一些指标如图,则每升该样品中含葡萄糖的质量为____g(请保留两位小数)。
9 | 白球比 | 1.6 | |
10 | 乳酸脱氢酶 | 161 | U/L |
11 | 磷酸肌酸激酶 | 56 | U/L |
12 | 甘油三酯 | 0.52 | mmol/L |
13 | 总胆固醇 | 4.27 | mmol/L |
14 | 高密度脂蛋白胆固醇 | 1.57 | mmol/L |
15 | 低密度脂蛋白胆固醇 | 1.40 | mmol/L |
16 | 葡萄糖 | 4.94 | mmol/L |