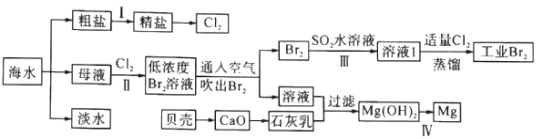
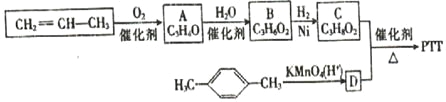
题目内容
【题目】按要求回答下列问题:
(1)常温下,测得0.1 mol·L-1Na2A溶液的pH=8,则Na2A溶液中各离子的浓度大小关系为______________。
(2)将0.2000 mol·L-1HB溶液与0.1000 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液中c(Na+)<c(B-)。
①混合溶液中c(B-)________(填“>”“<”或“=”)c(HB)。
②混合溶液中c(HB)+c(B-)________(填“>”“<”或“=”)2c(Na+)。
(3)已知在常温下常见弱酸的电离平衡常数Ka如表所示:
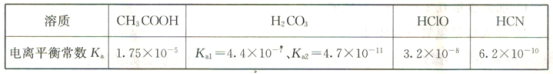
①同物质的量浓度的CH3COONa、NaClO、NaCN溶液中阴离子(不含OH-)浓度大小关系为____________。
②同pH的下列4种物质的溶液分别加水稀释100倍,pH变化最小的是________(填字母)。
a HCN b HClO c H2CO3 d CH3COOH
③常温下物质的量浓度相同的醋酸和醋酸钠混合液的pOH=8,则c(CH3COO-)-c(CH3COOH)=____________(用数值列出计算式即可) mol·L-1。
【答案】![]() > = CH3COO->ClO->CN- a 2×10-6-2×10-8
> = CH3COO->ClO->CN- a 2×10-6-2×10-8
【解析】
(1)常温下,测得0.1 mol·L-1Na2A溶液的pH=8,说明该盐属于强碱弱酸盐,水解显碱性,据此进行分析离子浓度大小关系;
(2)将0.2000 mol·L-1HB溶液与0.1000 mol·L-1 NaOH溶液等体积混合后溶液中的溶质为NaB和HB,且其物质的量之比为1:1;溶液中存在电荷守恒:![]() ,因为c(Na+)<c(B-),故c(H+)>c(OH-)溶液显酸性;因为题目中问到了c(HB),故HB为弱酸;
,因为c(Na+)<c(B-),故c(H+)>c(OH-)溶液显酸性;因为题目中问到了c(HB),故HB为弱酸;
(3)弱酸的电离平衡常数越大,酸性越强,其酸根阴离子的水解程度越弱。
(1)Na2A溶液pH=8,说明存在水解,Na2A溶液中存在的电离:![]() ;
;![]() (微弱);Na2A溶液中存在的水解:
(微弱);Na2A溶液中存在的水解:![]() ;
;![]() ;Na2A溶液中各离子的浓度大小关系为:
;Na2A溶液中各离子的浓度大小关系为:![]() ;
;
(2)①溶液存在电离:![]() ;同时存在水解
;同时存在水解![]() ;根据溶液显酸性可知电离程度大于水解程度,所以c(B-)>c(HB)故答案为:>;
;根据溶液显酸性可知电离程度大于水解程度,所以c(B-)>c(HB)故答案为:>;
②根据物料守恒可知c(HB)+c(B-)=2c(Na+),故答案为:=;
(3)①根据图表提供信息可知电离平衡常数:CH3COOH>HClO>HCN;故水解程度:CH3COONa<NaClO<NaCN,所以阴离子(不含OH-)浓度大小关系为CH3COO->ClO->CN-,故答案为:CH3COO->ClO->CN-;
②加水稀释时酸性越弱pH值变化越小,故答案为:a;
③根据常温下pOH=8,可知c(OH)=1×10-8 mol·L-1,c(H+)=1×10-6 mol·L-1;溶液中的电荷守恒为:![]() ;物料守恒为:
;物料守恒为:![]() ;相减消去钠离子可得:
;相减消去钠离子可得:![]() ,故答案为: 2×10-6-2×10-8。
,故答案为: 2×10-6-2×10-8。

【题目】I某课外兴趣小组对H2O2的分解速率做了如下实验探究。
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用![]() 10mL H2O2制取
10mL H2O2制取![]() 150mL O2所需的时间(秒)
150mL O2所需的时间(秒)
|
|
|
|
|
无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
无催化剂、加热 | 360 | 480 | 540 | 720 |
| 10 | 25 | 60 | 120 |
①该研究小组在设计方案时,考虑了温度、________、催化剂等因素对过氧化氢分解速率的影响。
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响: _____________。
(2)将质量相同但颗粒大小不同的MnO2分别加入到5mL5%的双氧水中,并用带火星的木条测试。测定结果如下:
催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 混合不振荡 | 剧烈反应,带火星的布条复燃 | 3.5分钟 |
块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
实验结果说明催化剂作用的大小与_________________________有关。
Ⅱ![]() 在体积为2L的密闭容器中充入1molH2 (g)和1molI2 (g),在一定温度下发生下列反应:
在体积为2L的密闭容器中充入1molH2 (g)和1molI2 (g),在一定温度下发生下列反应:![]()
![]()
![]() ,回答下列问题:
,回答下列问题:
(1)保持容器体积不变,向其中充入1molHI(g),反应速率_________(填“加快”“减慢”或“不变”)。
(2)保持容器内气体压强不变,向其中充入1mol氦气,反应速率_________________。(填“加快”“减慢”或“不变”)。
(3)反应进行到2min,测得容器内HI的浓度为0.2mol/L,用H2表示前2min该反应的平均化学反应速率为________________________,此时I2的转化率为____________。
【题目】[2016·新课标I]锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]_______________,有__________个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是______________________________。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因______________________________。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | 49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是______________________________。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为_______________,微粒之间存在的作用力是_______________。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0,![]() );C为(
);C为(![]() ,
,![]() ,0)。则D原子的坐标参数为_______________。
,0)。则D原子的坐标参数为_______________。

②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a=565.76 pm,其密度为_____g·cm3(列出计算式即可)。