题目内容
13.Ⅰ.3.2g Cu与30mL,8mol/L过量HNO3反应,硝酸的还原产物为NO,NO2,反应后溶液中所含H+为a mol,则:①此时溶液中所含的NO3-为(0.1+a)mol.
②所生成的NO在标准状况下体积为11.2(a-0.04) L.(以上结果均用含a的代数式表示)
Ⅱ.某黑色固体甲可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜.
查阅资料知道:①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在氧气流中煅烧,可以转化为氧化铜.②硫化铜和硫化亚铜常温下都不溶于稀盐酸.在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫.为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如图所示的实验:
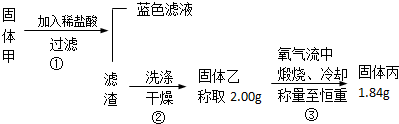
(1)③中在煅烧过程中一定发生的反应的化学方程式为2CuS+3O2$\frac{\underline{\;高温\;}}{\;}$2CuO+2SO2.
(2)关于固体甲的成分的判断中,下列说法正确的是BCD
A.固体甲中,CuS和Cu2S不能同时存在;
B.固体甲中,CuO和Cu2O至少有一种;
C.固体甲中若没有Cu2O,则一定有Cu2S;
D.固体甲中若存在Cu2O,也可能有Cu2S.
分析 Ⅰ.①反应硝酸有剩余,根据守恒守恒:2n(Cu2+)+n(H+)=n(NO3-),据此计算;
②根据N元素守恒计算NO、NO2总物质的量,再结合电子转移守恒列方程计算NO的物质的量,根据V=nVm计算NO的体积;
Ⅱ.(1)固体甲加入稀盐酸后,得到的蓝色溶液,说明固体甲的成分中CuO和Cu2O至少有一种,硫化铜和硫化亚铜常温下都不溶于稀盐酸,滤渣可能含有Cu、Cu2S、CuS,在灼烧时可能发生反应:Cu+O2=CuO、Cu2S+2O2=2CuO+SO2 、2CuS+3O2=2CuO+2SO2,从质量变化的角度分析;
(2)结合(1)的分析可知一定存在的反应,再根据固体质量变化进行分析判断.
解答 解:I.①n(Cu)=$\frac{3.2g}{64g/mol}$=0.05mol,反应后溶液存在Cu2+、H+、NO3-,
其中n(Cu2+)=n(Cu)=0.05mol,n(NO3-)=amol,
根据溶液呈电中性原则,可知溶液中存在:2n(Cu2+)+n(H+)=n(NO3-),
则n(NO3-)=2×0.05mol+amol=(0.1+a)mol,
故答案为:(0.1+a);
②根据N元素守恒,NO、NO2总物质的量=0.03L×8mol/L-amol=(0.24-a)mol,
设生成的NO、NO2的物质的量分别是xmol、ymol,则:x+y=(0.24-a)
由电子转移守恒,3x+y=0.05×2,
联立方程,解得x=(0.5a-0.02)
故NO的体积为(0.5a-0.02)mol×22.4L/mol=11.2(a-0.04)L
故答案为:11.2(a-0.04);
Ⅱ.(1)固体甲加入稀盐酸后,得到的蓝色溶液,说明固体甲的成分中CuO和Cu2O至少有一种,硫化铜和硫化亚铜常温下都不溶于稀盐酸,滤渣可能含有Cu、Cu2S、CuS,在灼烧时可能发生反应:
Cu+O2=CuO,导致固体质量增重,
Cu2S+2O2=2CuO+SO2 ,固体质量不变,
2CuS+3O2=2CuO+2SO2,固体质量减轻,
而实际固体质量减轻,故一定存在:2CuS+3O2$\frac{\underline{\;高温\;}}{\;}$2CuO+2SO2,
故答案为:2CuS+3O2$\frac{\underline{\;高温\;}}{\;}$2CuO+2SO2;
(2)固体甲加入稀盐酸后,得到的蓝色溶液,说明固体甲的成分中CuO和Cu2O至少有一种,硫化铜和硫化亚铜常温下都不溶于稀盐酸,滤渣可能含有Cu、Cu2S、CuS,
由(1)分析可知,煅烧时一定存在:2CuS+3O2$\frac{\underline{\;高温\;}}{\;}$2CuO+2SO2,说明甲必有CuS,
若有Cu2O,煅烧后固体质量减轻,Cu2S可有可无,与Cu2O用酸溶解得到Cu、CuS的量有关;
若无Cu2O,则一定含有CuO,若没有Cu2S,则CuS为2g,由2CuS+3O2 $\frac{\underline{\;高温\;}}{\;}$2CuO+2SO2可知,生成CuO质量为$\frac{2g}{98g/mol}$×80g/mol=1.63g<1.84g,则一定含有Cu2S,
经上分析,对于固体甲的成分的判断中,正确的是BCD,
故答案为:BCD.
点评 本题考查氧化还原反应计算、物质成分测定实验等,是对学生综合能力的考查,难度中等.

| A. | 标准状况下,22.4LSO3含有NA个分子 | |
| B. | 在18gH218O中含有10NA个中子 | |
| C. | 在2L0.5mol/L的醋酸溶液中含有NA个CH3COO离子 | |
| D. | 常温下,16gCH4含有10NA个电子 |
①AlCl3溶液蒸干灼烧得到氧化铝 ②碳酸钠溶液中离子共有4种
③电镀时应把镀件置于电解槽的阴极 ④冶炼铝时,把氧化铝加热成为熔融体后电解
⑤钢铁表面常易腐蚀生成Fe2O3•nH2O ⑥催化剂降低了活化能,故可以改变化学反应限度.
| A. | ①③④⑤ | B. | ①②③④⑤ | C. | ①③⑤⑥ | D. | ②④ |
| A. | 常温下0.4 mol/L HB溶液和0.2 mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(B-)>c(H+)>c(Na+)>c(OH-) | |
| B. | 同浓度同体积的NaClO溶液和CH3COONa溶液,离子总数前者小于后者 | |
| C. | 在1mol/L CH3COOH溶液中加入少量冰醋酸,醋酸的电离平衡正向移动且电离程度增大 | |
| D. | 常温下0.1 mol/L的下列溶液①NH4Al(SO4)2;②NH4Cl;③NH3•H2O;④CH3COONH4中,c(NH4+)由大到小的顺序是:②>①>④>③ |
| A. | 若Y的最低化合价为-2,则Z的最高正化合价为+6 | |
| B. | 若X的最高正化合价为+5,则五种元素都是非金属元素 | |
| C. | 若R(OH)n 为强碱,则W(OH)n+1也为强碱 | |
| D. | 若HnXOm为强酸,则Y是活泼非金属元素 |