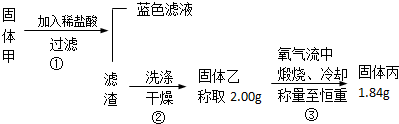
题目内容
1.下列叙述中,正确的是( )①AlCl3溶液蒸干灼烧得到氧化铝 ②碳酸钠溶液中离子共有4种
③电镀时应把镀件置于电解槽的阴极 ④冶炼铝时,把氧化铝加热成为熔融体后电解
⑤钢铁表面常易腐蚀生成Fe2O3•nH2O ⑥催化剂降低了活化能,故可以改变化学反应限度.
| A. | ①③④⑤ | B. | ①②③④⑤ | C. | ①③⑤⑥ | D. | ②④ |
分析 ①根据AlCl3属于强酸弱碱盐,在溶液中存在水解平衡,从平衡移动的角度分析并解答该题;
②碳酸钠在水溶液里进行两步水解,第一步水解生成碳酸氢钠和氢氧化钠,第二步水解生成碳酸和氢氧化钠;
③电镀时,镀层作阳极,镀件作阴极;
④氧化铝固体不导电,熔融状态下的氧化铝含有自由移动的阴阳离子而导电;
⑤钢铁易发生吸氧腐蚀而生成Fe2O3•nH2O;
⑥催化剂改变化学反应速率,不能改变化学反应限度,不影响化学平衡状态.
解答 解:①氯化铝为强酸弱碱盐,Al3+发生水解,水解的方程式为Al3++3H2O?Al(OH)3+3H+,水解后溶液呈酸性,蒸干和灼烧过程中,HCl挥发,Al(OH)3不稳定,灼烧时分解生成Al2O3,故①正确;
②碳酸根离子第一步水解生成碳酸氢根离子和氢氧根离子,第二步水解生成碳酸和氢氧根离子,盐类水解较微弱,所以溶液中存在的粒子有钠离子、氢氧根离子、氢离子、碳酸根离子、碳酸氢根离子、碳酸,故②错误;
③电镀时,镀件作电解池阴极,故③正确;
④氧化铝固体不导电,氧化铝在熔融状态下电离出阴阳离子而导电,所以冶炼铝时,把氧化铝加热成为熔融体后电解,故④正确;
⑤钢铁在潮湿的环境中能发生吸氧腐蚀,铁易失电子生成亚铁离子而作负极,碳作正极,正极上氧气得电子生成氢氧根离子,亚铁离子和氢氧根离子生成氢氧化亚铁,氢氧化亚铁不稳定,易被氧化生成氢氧化铁,氢氧化铁失水生成Fe2O3•nH2O,故⑤正确;
⑥催化剂改变化学反应速率,不能改变化学反应限度,不影响化学平衡状态,故⑥错误;
故选A.
点评 本题考查了金属的腐蚀与防护,明确原电池原理是解本题关键,知道各个电极上发生的电极反应式,注意钢铁发生吸氧腐蚀生成铁锈的原理,难度中等.

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
11.下列有关物质用途的叙述错误的是( )
| A. | 二氧化硅可制作光导纤维 | |
| B. | 因为氨易液化,在汽化时会吸收大量的热量,所以可作制冷剂 | |
| C. | 氧化钠在呼吸面具里作为氧气的来源 | |
| D. | 明矾可用作净水剂 |
16. 在密闭容器中发生可逆反应:3HCHO?(HCHO)3.在不同温度下,混合气体平均相对分子质量($\overline{{M}_{r}}$)与压强(p)的关系如图所示.下列有关推断正确的是( )
在密闭容器中发生可逆反应:3HCHO?(HCHO)3.在不同温度下,混合气体平均相对分子质量($\overline{{M}_{r}}$)与压强(p)的关系如图所示.下列有关推断正确的是( )
 在密闭容器中发生可逆反应:3HCHO?(HCHO)3.在不同温度下,混合气体平均相对分子质量($\overline{{M}_{r}}$)与压强(p)的关系如图所示.下列有关推断正确的是( )
在密闭容器中发生可逆反应:3HCHO?(HCHO)3.在不同温度下,混合气体平均相对分子质量($\overline{{M}_{r}}$)与压强(p)的关系如图所示.下列有关推断正确的是( )| A. | 若T2<T1,则△H<0 | B. | 平衡转化率:c<b=a | ||
| C. | 平衡常数:K(a)<K(c) | D. | $\overline{{M}_{r}}$=50时,HCHO的体积分数为$\frac{1}{3}$ |
10.以下电子排布式是激发态原子的电子排布的是( )
| A. | 1s22s1 | B. | 1s22s22p1 | C. | 1s22s22p63s2 | D. | 1s22s22p63p1 |