题目内容
5.为验证木炭可被浓硫酸氧化成二氧化碳,选用下图中的仪器(含所盛物质)组装成套实验装置,回答下列问题.(KMnO4能吸收SO2)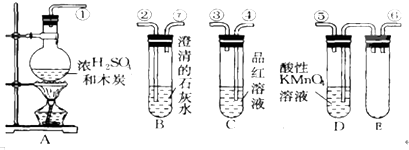
(1)在实验进行中,按气流方向从左到右的顺序,导管口的三处连接应该是①接⑥,⑤接④,③接②.
(2)试管B,C中各有什么现象,才能表示已检验出二氧化碳?B中澄清石灰水变浑浊,C中品红溶液不褪色;.
(3)试管D中能否用饱和NaHCO3溶液代替酸性KMnO4溶液?不能说明理由:若用碳酸氢钠饱和溶液,碳酸氢钠会与二氧化硫发生反应生成二氧化碳气体,则无法确定木炭是否被氧化成二氧化碳
(4)试管E的作用是防止倒吸
(5)写出A中反应的化学方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+SO2↑+2H20.
分析 (1)二氧化硫和二氧化碳都能够使澄清石灰水变浑浊,所以应该先除去二氧化硫并检验二氧化硫已经除尽,然后用澄清石灰水检验二氧化碳,据此连接导管;
(2)C中证明二氧化硫已经除尽,若气体还能够使澄清石灰水变浑浊,可以证明反应产物中含有二氧化碳;
(3)二氧化硫能够与碳酸氢钠溶液反应生成二氧化碳气体,干扰了二氧化碳的检验;
(4)E试管为安全瓶,具有防止倒吸的作用;
(5)浓硫酸的强氧化性,在加热条件下能够与碳反应生成二氧化碳、二氧化硫气体和水.
解答 解:(1)由于二氧化硫和二氧化碳都能够与澄清石灰水反应生成沉淀,所以应该先用酸性高锰酸钾溶液除去二氧化硫,然后用品红溶液检验二氧化硫是否除尽,最后用澄清石灰水检验二氧化碳,所以连接顺序为:①⑥⑤④③②,
故答案为:①;⑥;⑤;④;③;②;
(2)当C中品红溶液不褪色,证明混合气体中的二氧化硫已经除尽,若气体能够使B中澄清石灰水变浑浊,则证明混合气体中含有二氧化碳,
故答案为:澄清石灰水变浑浊;品红溶液不褪色;
(3)由于碳酸氢钠溶液能够与二氧化硫发生反应生成二氧化碳气体,则无法证明木炭是否被浓硫酸氧化成二氧化碳,故不能用饱和碳酸氢钠溶液代替酸性高锰酸钾溶液,
故答案为:不能;若用碳酸氢钠饱和溶液,碳酸氢钠会与二氧化硫发生反应生成二氧化碳气体,则无法确定木炭是否被氧化成二氧化碳;
(4)装置中E试管起到安全瓶的作用,可以防止倒吸,故答案为:防止倒吸;
(5)浓硫酸具有强氧化性,在加热条件下回合木炭发生氧化还原反应,生成二氧化碳、二氧化硫、水,反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+SO2↑+2H20,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+SO2↑+2H20.
点评 本题考查了浓硫酸的性质,题目难度中等,注意掌握浓硫酸的化学性质及常见气体的检验方法,明确实验目的为解答关键,如:本题中是检验二氧化碳气体,不需要检验二氧化硫.

| A. | 氢键是一种较弱的化学键 | |
| B. | NH3的稳定性很强,是因为其分子间能形成氢键 | |
| C. | 常温下,Cl2、Br2、I2的状态从气态、液态到固态,主要原因是分子间作用力在逐渐增大 | |
| D. | 最外层能达到稳定结构的微粒只是稀有气体的原子 |
下列说法不正确的是( )
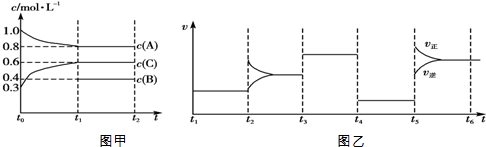
| A. | 该反应为吸热反应 | |
| B. | B在t0~t1阶段平衡时转化率为60% | |
| C. | t4~t5阶段改变的条件为减小压强 | |
| D. | 此温度下该反应的化学平衡常数K=$\frac{27}{32}$ |
| A. | XY3可能是共价化合物 | |
| B. | 若Y的原子序数为m,则X的原子序数只能是m±4 | |
| C. | X和Y可在同一周期,也可在两个不同的周期? | |
| D. | X和Y可在同一周期,也可在同一主族 |



 随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.
随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.