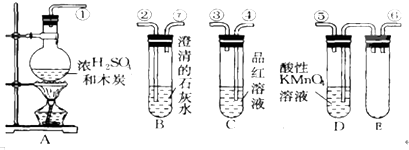
题目内容
8.已知:A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;
(1)A的电子式为:

(2)写出B、C化合物中官能团名称:B中含官能团羟基;C中含官能团羧基;
(3)写出反应的化学方程式及反应类型B物质在Cu作催化剂的条件下和氧气反应:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O 反应类型:氧化反应反应④的化学方程式:CH3COOCH2CH3+NaOH→CH3CH2OH+CH3COONa 反应类型:水解(取代)反应
(4)任写出两种D物质属于酯类的同分异构体结构简式CH3CH2COOCH3、HCOOCH2CH2CH3.
分析 A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平,则A为CH2=CH2,乙烯氧化可得羧酸,乙烯与水加成可得乙醇,根据B、C反应生成D,D水解得B和E,结合D的分子式可知,B为CH3CH2OH,C为CH3COOH,D为CH3COOCH2CH3,E为CH3COONa,据此答题;
解答 解:A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平,则A为CH2=CH2,乙烯氧化可得羧酸,乙烯与水加成可得乙醇,根据B、C反应生成D,D水解得B和E,结合D的分子式可知,B为CH3CH2OH,C为CH3COOH,D为CH3COOCH2CH3,E为CH3COONa,
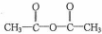
(1)A为CH2=CH2,电子式为 ,
,
故答案为: ;
;
(2)根据上面的分析可知,B为CH3CH2OH,C为CH3COOH,B中含官能团为羟基,C中含官能团为羧基,
故答案为:羟基;羧基;
(3)B为CH3CH2OH,B物质在Cu作催化剂的条件下和氧气反应方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,反应类型为氧化反应,反应④是CH3COOCH2CH3的碱性水解,反应的化学方程式为CH3COOCH2CH3+NaOH→CH3CH2OH+CH3COONa,反应类型为水解(取代)反应,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;氧化反应;CH3COOCH2CH3+NaOH→CH3CH2OH+CH3COONa;水解(取代)反应;
(4)D为CH3COOCH2CH3,D物质属于酯类的同分异构体结构简式为 CH3CH2COOCH3、HCOOCH2CH2CH3等,
故答案为:CH3CH2COOCH3、HCOOCH2CH2CH3.
点评 本题考查有机物的推断,涉及烯、醇、羧酸等性质与转化,难度不大,是对有机基础知识的综合运用,注意对基础知识的理解掌握.

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案| A. | 钇在周期表中的位置是第4周期ⅢB族 | |
| B. | 属于非金属元素 | |
| C. | ${\;}_{39}^{89}$Y和${\;}_{39}^{90}$Y是两种不同的核素 | |
| D. | 中子数为39 |
| A. | 石油裂解得到的汽油是纯净物 | |
| B. | 石油产品都可用于聚合反应 | |
| C. | 天然气是一种清洁的化石燃料 | |
| D. | 水煤气是通过煤的液化得到的气体燃料 |
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | L2+与R2-的核外电子数相等 | |
| B. | M与T形成的化合物具有两性 | |
| C. | 氢化物的稳定性为H2T<H2R | |
| D. | 单质与浓度相等的稀盐酸反应的速率为Q>L |
| A. | 钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠 | |
| B. | 因同周期元素的原子半径从左到右逐渐减小,故第一电离能必依次增大 | |
| C. | 最外层电子排布为ns2np6(若只有K层时为1s2)的原子,第一电离能较大 | |
| D. | 对于同一元素而言,原子的逐级电离能越来越大 |
| A. | 0.12 mol | B. | 0.11 mol | C. | 0.09 mol | D. | 0.08 mol |
 .
.
 ;反应⑤的化学方程式为
;反应⑤的化学方程式为 .
.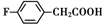 、
、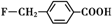 .
. 和乙酸酐为原料制备
和乙酸酐为原料制备 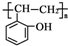 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选).合成路线流程图示例如下: 2015年3月,全国“两会”代表委员就我国“雾霾”治理积极建言献策.科学家研究表明氮氧化物与悬浮在大气中的盐粒子相互作用时能产生“二次雾霾”,涉及的反应有:
2015年3月,全国“两会”代表委员就我国“雾霾”治理积极建言献策.科学家研究表明氮氧化物与悬浮在大气中的盐粒子相互作用时能产生“二次雾霾”,涉及的反应有: