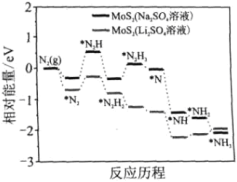
题目内容
【题目】一定温度时,向2.0 L恒容密闭容器中充入2 mol SO2和1 mol O2,发生反应:2SO2(g)+O2(g) ![]() 2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t / s | 0 | 2 | 4 | 6 | 8 |
n(SO3) / mol | 0 | 0. 8 | 1. 4 | 1.8 | 1.8 |
下列说法正确的是
A. 反应在前2 s 的平均速率v(O2) = 0. 4 mol·L-1·s-1
B. 保持其他条件不变,体积压缩到1.0 L,平衡常数将增大
C. 相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率大于10%
D. 保持温度不变,向该容器中再充入2 mol SO2、1 mol O2,反应达到新平衡时n(SO3)/n(O2)增大
【答案】D
【解析】
A.根据表格中数据可知,当n(SO3)=1.8mol,该反应达到平衡状态,反应在前2s的平均速率v(SO3)=0.8mol÷2L÷2s=0.2mol·L-1·s-1,同一可逆反应中同一段时间内各物质的反应速率之比等于其计量数之比,v(O2)=1/2v(SO3)=1/2×0.2mol·L-1·s-1=0.1mol·L-1·s-1,故A错误;
B.化学平衡常数只与温度有关,温度不变,化学平衡常数不变,与压强、物质浓度都无关,故B错误;
C.相同温度下,起始时向容器中充入4molSO3,如果三氧化硫完全转化为二氧化硫和氧气,二氧化硫和氧气的物质的量分别是4mol、2mol,为原来的2倍,增大压强平衡正向移动,则二氧化硫的转化率增大,原平衡,SO2的转化率为1.8mol/2mol×100%=90%,所以二氧化硫的转化率大于90%,当向容器中充入2molSO3时,SO3的转化率等于10%,相同温度下,当充入4 molSO3,相当于加压,SO3的转化率减小,应小于10%,故C错误;
D.保持温度不变,向该容器中再充入2molSO2、1molO2,相当于缩小容器的体积,增大了压强,平衡正向移动,三氧化硫的物质的量增加,氧气的物质的量进行,所以n(SO3)/n(O2)增大,故D正确。
故选D。

【题目】甲醇是一种可再生能源,具有广阔的开发和应用前景,可用Pt/Al2O3、Pd/C、 Rh/SiO2等作催化剂,采用如下反应来合成甲醇:2H2 (g)+CO(g)CH3OH(g)
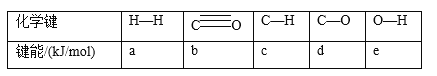
(1)下表所列数据是各化学键的键能,该反应的ΔH=_______(用含字母的代数式表示)。
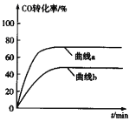
(2)某科研小组用Pd/C作催化剂,在450℃时,研究了n(H):n(CO)分别为2:1、3:1时CO转化率的变化情况(如图),则图中表示n(H2):n(CO)=3:1的变化曲线为______(填“曲线a"或“曲线b”)。
(3)某化学研究性学习小组模拟工业合成甲醇的反应,在2L的恒容密闭容器内充入1 mol CO和2molH2,加入合适催化剂后在某温度下开始反应,并用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
则从反应开始到20min时,CO的平均反应速率为________,该温度下的平衡常数K为_______.
(4)将CO和H2加入密闭容器中,在一定条件下发生反应:CO(g)+2H2(g) CH3OH(g) ΔH<0。平衡时CO的体积分数(%)与温度和压强的关系如下图所示(虚线框表示没有测定该条件下的数据)。
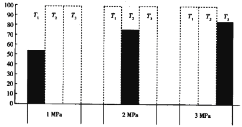
T1、T2、T3由大到小的关系是_________,判断理由是____________
(5)美国的两家公司合作开发了多孔硅甲醇直接燃料电池,其工作原理如图
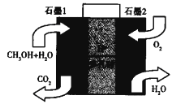
①石墨2为__________ (填“正“或“负“)极。
②石墨1极发生的电极反应式为________