题目内容
【题目】A,B,C,D,E五种短周期元素,它们的原子序数依次增大。B原子的最外层电子数是其次外层电子数的2倍。A的一种原子中,质量数与质子数之差为零。D元素原子的最外层电子数为m,次外层电子数为n。E元素原子的L层上电子数为(m+n),M层上电子数为 ![]() 。请回答下列问题:
。请回答下列问题:
(1)B元素是________(填元素名称)D元素在周期表中的位置是_______
(2)C与E形成的化合物E3C属于________(填“原子”“离子”或“分子”)晶体。
(3)由A,D,E元素组成的化合物中存在的化学键类型是________
(4)写出一个E和D形成的化合物与水发生氧化还原反应的离子方程式:________
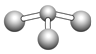
(5)已知:甲+H2O→丙+丁,该反应不是氧化还原反应。若甲是由N和Cl元素组成的化合物,其分子结构模型如图所示,丁与H2O有相同的电子总数,则丙的电子式为________
(6)与D同主族且上下相邻的元素M、N,原子电子层数M>N>D,三种元素的氢化物的沸点由大到小的顺序是________(填化学式)
【答案】碳 第二周期VIA族 离子 离子键、共价键 2Na2O2+2H2O=4Na++4OH+O2↑  H2O>H2Se>H2S
H2O>H2Se>H2S
【解析】
“ B原子的最外层电子数是其次外层电子数的2倍”则B为C;“A的一种原子中,质量数与质子数之差为零”则A为H;由D、E的原子核外电子结构可得m+n=8,且D的原子核外有两个电子层,则n=2,m=6;因此D为O,则C为N;E的M层上电子数为1,则E为Na。
(1)由分析可知,B为碳元素,D为氧元素,氧元素位于元素周期表第二周期ⅥA族;故答案为:碳,第二周期ⅥA族。
(2)由分析可知,C为N,E为Na,二者形成的化合物为Na3N,属于离子晶体;故答案为:离子。
(3)由分析可知,A为H、D为O、E为Na,因此A、D、E三种元素组成的化合物为NaOH,其中含有离子键和共价键;故答案为:离子键、共价键。
(4)E和D形成的化合物为Na2O2和Na2O,其中能与水发生氧化还原反应的为Na2O2, 故答案为:![]() 。
。
(5)由甲的分子结构模型可知,甲的化学式为NCl3 , 与H2O的反应不是氧化还原反应,则反应过程中,元素化合价没有发生变化,化学方程式为:NCl3+3H2O=NH3+3HClO,由于产物丁与H2O具有相同的电子数,因此丁的化学式为NH3,因此丙为HClO,故答案为: ;
;
(6)由分析可知,D为O,M、N与D同主族,且原子电子层数M>N>D,则M为Se、N为S;由于H2O中含有氢键,因此其沸点最高,H2Se和H2S都为分子晶体,且结构相似,因此其相对原子质量越大,沸点越高,因此沸点H2Se>H2S,故三种元素氢化物的沸点由大到小的顺序为:H2O>H2Se>H2S;故答案为:H2O>H2Se>H2S。

 阅读快车系列答案
阅读快车系列答案【题目】向1L浓度均为![]() 和氢氧化钠的混合溶液中缓慢加入二氧化碳,随
和氢氧化钠的混合溶液中缓慢加入二氧化碳,随![]() 增大,溶液中下列离子浓度对应关系正确的是 ( )
增大,溶液中下列离子浓度对应关系正确的是 ( )
选项 |
| 溶液中离子的物质的量浓度关系 |
A |
| c(Na+)>c(CO32-)>c(OH-)>c(AlO2-) |
B |
|
|
C |
|
|
D |
|
|
A.AB.BC.CD.D

