题目内容
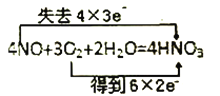
【题目】温度恒定的条件下,在2L容积不变的密闭容器中,发生反应:2SO2(g)+O2(g)![]() 2SO3(g)。开始充入4mol的SO2和2mol的O2,10s后达到平衡状态,此时c(SO3)=0.5 mol·L-1,下列说法不正确的是( )
2SO3(g)。开始充入4mol的SO2和2mol的O2,10s后达到平衡状态,此时c(SO3)=0.5 mol·L-1,下列说法不正确的是( )
A.v(SO2)∶v(O2)=2∶1B.10s内,v(SO3)=0.05mol·L-1·s-1
C.SO2的平衡转化率为25%D.平衡时剩余SO2的物质的量为3.5mol
【答案】D
【解析】
根据方程式利用三段法进行计算并判断。
平衡时n(SO3)= 0.5 mol·L-1×2L=1mol
2SO2(g) + O2(g) ![]() 2SO3(g)
2SO3(g)
始(mol) 4 2 0
转(mol) 1 0.5 1
平(mol) 3 1.5 1
A. 由以上分析可知v(SO2)=![]() =0.05mol·L-1·s-1,v(O2)=
=0.05mol·L-1·s-1,v(O2)=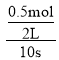 =0.025mol·L-1·s-1,则v(SO2)∶v(O2)=0.05:0.025=2∶1,A项正确;
=0.025mol·L-1·s-1,则v(SO2)∶v(O2)=0.05:0.025=2∶1,A项正确;
B. v(SO3)=![]() =0.05mol·L-1·s-1,B项正确;
=0.05mol·L-1·s-1,B项正确;
C. SO2的平衡转化率=![]() ×100%=25%,C项正确;
×100%=25%,C项正确;
D.由以上分析知平衡时剩余SO2的物质的量为3mol,D项错误;
答案选D。

【题目】2019年诺贝尔化学奖授予约翰·古迪纳夫、斯坦利·威廷汉和吉野彰,表彰他们对锂离子电池研究的贡献。磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片(除LiFePO4外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,部分流程如图:
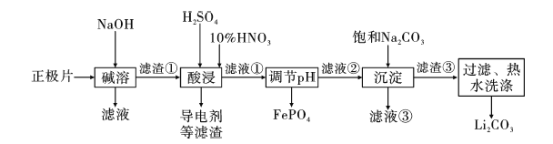
已知:KSP ( Li2CO3)=2.0×10-3 。部分物质的溶解度(S)如下表所示:
T℃ | S(Li2CO3)/g | S(Li2SO4)/g | S(Li3PO4)/g |
20 | 1.33 | 34.2 | 0.039 |
80 | 0.85 | 30.5 | —— |
100 | 0.72 | —— |
(1) 流程中用“热水洗涤”的原因是____________。
(2)写出碱溶时Al箔溶解的化学方程式 ___________。
(3)酸浸时,用H2O2代替HNO3更好,其优点是________。
(4)磷酸亚铁锂电池在工作时,正极发生LiFePO4和FePO4的转化,该电池放电时正极的电极反应式为____。
(5)若滤液②中c(Li+)=4mol/L,加入等体积的Na2CO3溶液后,Li+的沉降率达到90%,计算滤液③中c(CO32-)=____mol/L