题目内容
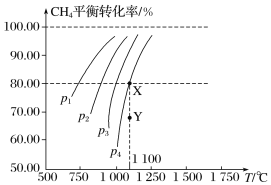
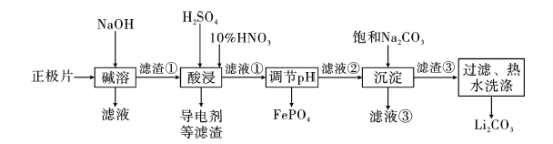
【题目】2019年诺贝尔化学奖授予约翰·古迪纳夫、斯坦利·威廷汉和吉野彰,表彰他们对锂离子电池研究的贡献。磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片(除LiFePO4外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,部分流程如图:
已知:KSP ( Li2CO3)=2.0×10-3 。部分物质的溶解度(S)如下表所示:
T℃ | S(Li2CO3)/g | S(Li2SO4)/g | S(Li3PO4)/g |
20 | 1.33 | 34.2 | 0.039 |
80 | 0.85 | 30.5 | —— |
100 | 0.72 | —— |
(1) 流程中用“热水洗涤”的原因是____________。
(2)写出碱溶时Al箔溶解的化学方程式 ___________。
(3)酸浸时,用H2O2代替HNO3更好,其优点是________。
(4)磷酸亚铁锂电池在工作时,正极发生LiFePO4和FePO4的转化,该电池放电时正极的电极反应式为____。
(5)若滤液②中c(Li+)=4mol/L,加入等体积的Na2CO3溶液后,Li+的沉降率达到90%,计算滤液③中c(CO32-)=____mol/L
【答案】Li2CO3的溶解度随温度升高而減小,热水洗涤可減少Li2CO3的溶解 2Al+2OH-+2H2O=2AlO2-+3H2↑ 不产生污染环境的气体 FePO4+Li++e-= LiFePO4 0.05
【解析】
(1)由题给表格数据可知,温度升高,Li2CO3的溶解度減小,所以热水洗涤可減少Li2CO3的溶解而提高产率。
(2)碱溶时,Al箔与氢氧化钠溶液反应生成偏铝酸钠和氢气。
(3)酸浸时,LiFePO4与混酸反应生成硫酸锂、硫酸铁、磷酸、一氧化氮和水,若用H2O2代替HNO3,不会产生污染环境的NO气体。
(4) 正极发生LiFePO4和FePO4的转化,则应为FePO4的转化为LiFePO4。
(5)当滤液②中c(Li+)=4mol·L-1,加入等体积的Na2CO3后,c(Li+)=2mol·L-1,若Li+的沉降率达到90%,反应生成Li2CO3后溶液中c(Li+)=2mol·L-1×0.1=0.2 mol·L-1,由碳酸锂溶度积Ksp(Li2CO3)=c2(Li+)c(CO32—)=2.0×10-3,可得c(CO32-)=![]() 。
。
(1)由题给表格数据可知,Li2CO3的溶解度随温度升高而減小,热水洗涤可減少Li2CO3的溶解而提高产率。答案为:Li2CO3的溶解度随温度升高而減小,热水洗涤可減少Li2CO3的溶解;
(2)碱溶时,Al箔与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑。答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)酸浸时,LiFePO4与混酸反应生成硫酸锂、硫酸铁、磷酸、一氧化氮和水,反应的化学方程式为6LiFePO4+12H2SO4+2HNO3=3Li2SO4+3Fe2(SO4)3+6H3PO4+2NO↑+4H2O,若用H2O2代替HNO3,则不会产生污染环境的NO气体,从而保护了环境。答案为:不产生污染环境的气体;
(4) 正极发生LiFePO4和FePO4的转化,则应为FePO4的转化为LiFePO4,该电池放电时正极的电极反应式为FePO4+Li++e-= LiFePO4。答案为:FePO4+Li++e-= LiFePO4;
(5)当滤液②中c(Li+)=4mol·L-1,加入等体积的Na2CO3后因为溶液的稀释使得c(Li+)=2mol·L-1,若Li+的沉降率达到90%,反应生成Li2CO3后溶液中c(Li+)=2mol·L-1×0.1=0.2 mol·L-1,由碳酸锂溶度积Ksp(Li2CO3)=c2(Li+)c(CO32—)=2.0×10-3,可得c(CO32-)=![]() =0.05 mol·L-1,故答案为:0.05。
=0.05 mol·L-1,故答案为:0.05。

 黄冈创优卷系列答案
黄冈创优卷系列答案【题目】某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质。
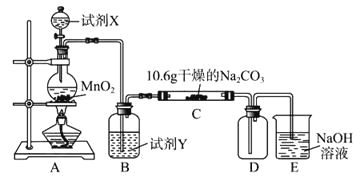
(1)写出装置A中发生反应的化学方程式:__________________________________。
(2)写出试剂Y的名称:___________________。
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物。可以确定的是C中含有的氯盐只有一种,且含有NaHCO3,现对C成分进行猜想和探究。
①提出合理假设。
假设一:存在两种成分: NaHCO3和___________;
假设二:存在三种成分: NaHCO3和___________、_____________。
②设计方案,进行实验。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
实验步骤 | 预期现象和结论 |
步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中。 | |
步骤2:_____________________ | ____________ |
步骤3:__________ | _______________ |
(4)已知C中有0.1 mol Cl2参加反应。若假设一成立,可推知C中反应的化学方程式为_______________________________________。