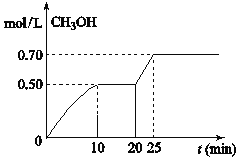
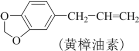
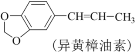
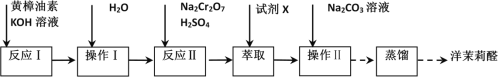
题目内容
【题目】某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其核电荷数,请你根据下面的提示做出自己的判断。
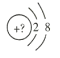
(1)若该微粒是电中性微粒,这种微粒的元素符号是___。
(2)若该微粒的还原性很弱,失去1个电子后变为原子,该原子的单质氧化性很强,该单质与水反应的化学方程式为___。
(3)若该微粒的氧化性很弱,得到1个电子后变为原子,该原子的单质还原性很强,该单质在氧气中燃烧所得产物的化学式为___。
(4)若该微粒的还原性很弱,失去2个电子后变成原子,其氢化物的结构式为___。
【答案】Ne 2F2+2H2O=4HF+O2 Na2O2 H—O—H或H—O—O—H
【解析】
按相应粒子的性质推测元素并按要求回答;
(1)由该单核微粒的结构示意图可知,其核外有10个电子,若该微粒是电中性微粒,由核电荷数=核外电子数可知,这种微粒是Ne原子;答案为:Ne;
(2)若该微粒的还原性很弱,失去1个电子后变为原子,说明该元素的原子含有9个电子,为F元素,F2和水反应生成HF和O2,化学方程式为![]() ;答案为:2F2+2H2O=4HF+O2;
;答案为:2F2+2H2O=4HF+O2;
(3)若该微粒的氧化性很弱,得到1个电子后变为原子,说明该元素的原子含有11个电子,为Na元素,Na在氧气中燃烧生成Na2O2;答案为:Na2O2;
(4)若该微粒的还原性很弱,失去2个电子后变成原子,说明该元素的原子含有8个电子,为O元素,O元素的氢化物是H2O或H2O2,结构式为H—O—H或H—O—O—H;答案为:H—O—H或H—O—O—H。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案【题目】a~n10中元素在周期表中的位置如图所示,请回答下列问题:
a | ||||||||
b | c | d | e | |||||
f | g | h | m | n | ||||
…… |
(1)m的阴离子的结构示意图为___。
(2)b的最高价氧化物的化学式为___;用化学方程式表示f、d的单质形成f2d2的过程___。
(3)d、g、n形成的简单离子的半径由大到小的顺序为___(用离子符号表示)。
(4)以上元素组成的物质有下列框图中的转化关系,其中甲为10电子微粒。
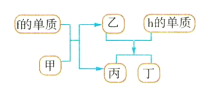
请写出h的单质与乙反应的化学方程式:___。
【题目】表是元素周期表的一部分,请用元素符号、离子符号或相关化学式回答有关问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)表中能形成两性氢氧化物的元素在周期表中的位置是________;
(2)写出②的气态氢化物的结构式________;
(3)元素④⑤⑥⑦离子半径由大到小的顺序________;
(4)①、⑥、⑦三种元素的最高价氧化物的水化物中酸性最强的是________;④、⑤、⑨三种元素的最高价氧化物的水化物中碱性最强的是
(5)⑦和⑩氧化性较强的是________用一个置换反应证实这一结论(写化学方程式)___________________________。
(6)④⑤两元素相比较,金属性较强的是________,可以验证该结论的实验是________;
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将形状、大小相同的这两种元素的单质用砂纸打磨后分别和同浓度的盐酸反应
(c)将形状、大小相同两种元素的单质用砂纸打磨后分别和热水作用,并滴入酚酞
(d)比较这两种元素的气态氢化物的稳定性