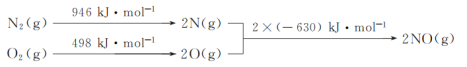题目内容
【题目】甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2 )在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH 3OH(g)+H2O(g) △H2
CH 3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
已知反应①中相关的化学键键能数据如下:
化学键 | H—H | C—O |
| H—O | C—H |
E/(kJ mol-1) | 436 | 343 | 1076 | 465 | 413 |
回答下列问题:
(1)CH3OH中氧在周期表中位于___,属于___区元素,与其同周期相邻两种元素原子的第一电离能由大到小的顺序为___(用元素符号表示),其原因是___。
(2)写出CH3OH的结构式___;反应①的热化学方程式(热量用具体数值表示)___。
(3)当△H2=-58kJ mol-1,则△H3=__kJ mol-1。
(4)CO和H2的混合气体又称水煤气,可由水和煤在一定条件下产生,写出该反应的化学方程式___。
【答案】第二周期VIA族 P F>N>O 同一周期从左至右第一电离能逐渐增大,但N元素2p轨道为半充满稳定状态,第一电离能反常增大,因而F>N>O 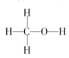 CO(g)+2H2(g)
CO(g)+2H2(g)![]() CH3OH(g) △H=-99kJ mol-1 +41 C +H2O
CH3OH(g) △H=-99kJ mol-1 +41 C +H2O![]() CO+H2
CO+H2
【解析】
(1)O为8号元素,核外有8个电子为非金属元素;同周期从左向右,第一电离能逐渐增大;
(2)甲醇中各原子都是以共价单键结合形成的;根据△H=反应物的总键能-生成物的总键能计算出反应热后,书写正确的热化学方程式;
(3)根据盖斯定律可知,反应②-反应①=反应③,据此计算△H3;
(4)C与水蒸气反应生成CO和H2。
(1)O为8号元素,位于第二周期第VIA族,位于P区;与其同周期相邻两种元素为N、F,同周期,从左向右,第一电离能逐渐增大,但N元素2p轨道为半充满稳定状态,第一电离能反常增大,因此第一电离能F>N>O;
(2)甲醇中各原子都是以共价单键结合形成的,结构式为: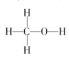 ;对于反应①的反应热△H=反应物的总键能-生成物的总键能,因此△H1=1076+2×436-(3×413+343+465) kJ mol-1=-99 kJ mol-1,因此热化学方程式为:CO(g)+2H2(g)
;对于反应①的反应热△H=反应物的总键能-生成物的总键能,因此△H1=1076+2×436-(3×413+343+465) kJ mol-1=-99 kJ mol-1,因此热化学方程式为:CO(g)+2H2(g)![]() CH3OH(g) △H=-99kJ mol-1;
CH3OH(g) △H=-99kJ mol-1;
(3)根据盖斯定律可知,反应②-反应①=反应③,因此△H3=△H2-△H1=-58 kJ mol-1-(-99 kJ mol-1)=+41 kJ mol-1;
(4)C与水蒸气反应生成CO和H2,反应方程式为:C +H2O![]() CO+H2。
CO+H2。

 阅读快车系列答案
阅读快车系列答案【题目】某实验小组研究KI和酸性KMnO4溶液的反应。
实验序号 | Ⅰ | Ⅱ |
实验操作 |
|
|
实验现象 | 紫色褪去,溶液变为棕黄色 | 紫色溶液迅速变为棕褐色悬浊液,然后沉淀消失,溶液变为棕黄色 |
资料:i. MnO4— 在酸性条件下最终被还原为Mn2+。ii. 酸性条件下氧化性: KMnO4>KIO3>I2 。
(1)实验1中溶液呈棕黄色,推测生成了________。
(2)实验小组继续对实验II反应中初始阶段的产物成分进行探究:

①经检验,实验II初始阶段I— 的氧化产物不是I2,则“实验现象a”为________。
②黑色固体是________。
③设计实验方案证明在“紫色清液”中存在IO3-:________。
④写出生成IO3-的离子方程式:________。
(3)探究实验II中棕褐色沉淀消失的原因。

用离子方程式解释实验II中棕褐色沉淀消失的原因:________。
(4)实验反思:KI和酸性KMnO4溶液反应过程中,所得产物成分与________有关(写出两点即可)。