题目内容
【题目】A、B、C、D、E、F六种常见的单质或化合物在一定条件下有如下图所示的相互转化关系,所有反应物和生成物均已给出。
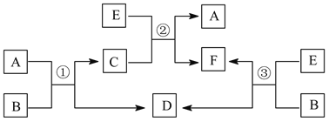
(1)若B在常温下为液态;C是一种有磁性的化合物;E是一种无色、无味的有毒气体。则反应③的化学方程式______________。
(2)若B由两种元素组成,其简单离子的电子层结构相同;绿色植物的光合作用和呼吸作用可实现自然界中D、E的循环。则B的电子式为_________________,11.6 g A和E组成的混合气体与足量的B固体反应,固体增重3.6 g,则A、E混合气中E 的体积分数为_________________________。
(3)若A和E都是第四周期常见的金属单质,其余都是常见的盐,反应①②③都在溶液中进行,则B、C、F氧化性由强到弱顺序为(用离子符号表示)____________。
【答案】CO+H2O![]() CO2+H2
CO2+H2 ![]() 20% Fe3+>Cu2+>Zn2+
20% Fe3+>Cu2+>Zn2+
【解析】
(1)若在常温下为液态,则B是水,C是一种有磁性的化合物,则A为Fe,C为Fe3O4,D为H2,E是一种无色、无味的有毒气体,由转化关系可知,E为CO,F为CO2;
(2)若B由两种元素组成,其简单离子的电子层结构相同,绿色植物的光合作用和呼吸作用能实现自然界中D和E的循环,则D和E分别是CO2 和O2的一种,可以推断B是Na2O2,由反应①可知E和A反应生成D,由反应③可知E和B反应生成D,则D是O2;结合反应②、反应③可知E是CO2,F为Na2CO3,A为H2O,C为NaOH;
(3)若A和E都是第四周期常见的金属单质,其余都是常见的盐,反应①②③都在溶液中进行,则根据物质转化关系可知:A为Cu单质,B含Fe3+,C含Cu2+,D含Fe2+,E为Zn,F含Zn2+。据此解答。
(1)根据上述分析可知:A为Fe,B为H2O,C为Fe3O4,D为O2,E为CO,F为CO2。反应③是CO与H2O在高温下反应产生CO2和H2,反应方程式为:CO+H2O![]() CO2+H2;
CO2+H2;
(2)根据上述分析可知:A为H2O,B为Na2O2,C为NaOH,D为H2,E为CO2,F为Na2CO3。
B是Na2O2,该物质是离子化合物,电子式为:![]() ;
;
11.6 g H2O、CO2的混合气体与足量Na2O2发生反应:2Na2O2+2H2O=4NaOH+O2↑,2Na2O2+2CO2=2Na2CO3+O2,固体增重3.6 g,假设混合气体中H2O、CO2的物质的量分别是x、y,则18x+44y=11.6,根据方程式中物质反应转化关系可知2x+28y=3.6,解得x=0.4 mol,y=0.1 mol,由于在相同条件下气体的体积比等于气体的物质的量的比,所以H2O、CO2的混合气体中CO2的体积分数为:![]() ×100%=20%;
×100%=20%;
(3)根据上述分析可知:A为Cu单质,B为含Fe3+的盐,C为含Cu2+的盐,D为含Fe2+的盐,E为Zn,F为含Zn2+的盐。反应①为Cu+2Fe3+=2Fe2++Cu2+,可知物质的氧化性:Fe3+>Cu2+;反应②为Zn+Cu2+=Zn2++Cu2+,可知物质的氧化性:Cu2+>Zn2+;反应③为Zn+2Fe3+=2Fe2++Zn2+,可知物质的氧化性:Fe3+>Zn2+。则Fe3+、Cu2+、Zn2+的氧化性由强到弱的顺序为:Fe3+>Cu2+>Zn2+。