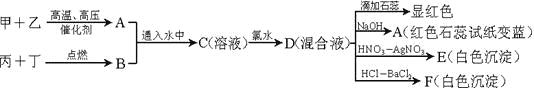
题目内容
【题目】某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。请回答下列问题:

(1)甲池为__________(填原电池、电解池或电镀池),通入甲醇电极的电极反应式 为______________________________________________。
(2)乙池中B电极为______(填“正极”、“负极”、“阴极”或“阳极”),该池的总反应化学方程式为__________________________________________。
(3)当乙池中B极质量增重5.4g时,甲池中理论上消耗O2的体积为______mL(标准状况)。
(4)丙池中,C上的电极反应式为____________________________________。
【答案】原电池 CH3OH-6e -+8OH-=CO32- +6H2O 阴极 4AgNO3+2H2O![]() 4Ag+O2↑+4HNO3 280 4OH--4e-=2H2O+O2
4Ag+O2↑+4HNO3 280 4OH--4e-=2H2O+O2![]()
【解析】
由装置图可知甲池为原电池,CH3OH燃料做负极,负极失电子发生氧化反应,在碱性溶液中生成碳酸盐,乙、丙为电解池,乙池中A为阳极,B为阴极,电池中是电解硝酸银溶液生成单质银,丙池中D为阴极,C为阳极,阳极上溶液中的OH-失电子发生氧化反应。以此进行判断。
(1)甲池为原电池,燃料在负极失电子发生氧化反应,在碱性溶液中生成碳酸盐,甲池中通入CH3OH电极的电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O;答案:原电池;CH3OH-6e-+8OH-=CO32-+6H2O;
(2)乙池是电解池,A为阳极,B为阴极,电池中是用惰性电极电解硝酸银溶液,阳极是水电离的氢氧根离子失电子生成氧气,阴极是银离子得到电子生成单质银,电池的总反应方程式为:4AgNO3+2H2O![]() 4Ag+O2↑+4HNO3;答案:阴极;4AgNO3+2H2O
4Ag+O2↑+4HNO3;答案:阴极;4AgNO3+2H2O![]() 4Ag+O2↑+4HNO3;
4Ag+O2↑+4HNO3;
(3)乙池中B极是阴极,银离子得电子生成银,物质的量n=![]() =0.05mol,依据电子守恒计算4Ag~O2~4e-,所以甲池中理论上消耗O2的物质的量为0.0125mol,标况下体积0.0125mol
=0.05mol,依据电子守恒计算4Ag~O2~4e-,所以甲池中理论上消耗O2的物质的量为0.0125mol,标况下体积0.0125mol![]() 22.4L/mol=0.28L=280mL;答案:280;
22.4L/mol=0.28L=280mL;答案:280;
(4)丙池为电解硫酸铜溶液,D为阴极,C为阳极,阳极上溶液中的OH-失电子发生氧化反应,其电极反应式为4OH--4e-=2H2O+O2↑,答案:4OH--4e-=2H2O+O2![]() 。
。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案【题目】(1)BN是一种新型无机材料,由于_________与_________属于等电子体物质,其结构和性质具有极大的相似性,则可推知,在BN的两种晶型中,一种是类似_________的空间网状结构晶体,可用作耐磨材料,另一种是类似于__________的层状结构的混合型晶体,可用作润滑材料,在其结构的每一层上最小的封闭环中有_________个B原子,B—N键角为_________
(2)单质硼有无定形和晶体两种,参考表中数据:
金刚石 | 晶体硅 | 晶体硼 | |
熔点(K) | 3823 | 1683 | 2573 |
沸点(K) | 5100 | 2628 | 2823 |
硬度(M06) | 10 | 7.0 | 9.5 |
①晶体硼的晶体类型属于__________晶体,理由是_______________
②已知晶体硼的基本结构单元是由硼原子组成的正二十面体,如图所示其中20个等边三角形的面和一定数目的顶点,每个顶点上各有1个硼原子。通过观察图形及推算,此基本结构单元由_________个硼原子构成,其中B—B键的键角为___________