题目内容
9.下列关于原电池说法正确的是( )| A. | 由Al、Cu、浓硝酸组成的原电池,其负极反应式为:Cu-2e-=Cu2+ | |
| B. | 由Al、Mg、NaOH组成的原电池,其负极反应式为:Al-3e-+3OH-=Al(OH)3↓ | |
| C. | 由Al、Mg、稀硫酸组成的原电池,其负极反应式为:Al-3e-=Al3+ | |
| D. | 由Fe、Cu、FeCl3组成的原电池,其正极反应式为:Cu-2e-=Cu2+ |
分析 A、由Al、Cu与浓硝酸组成的原电池,该条件下,铜易失电子而作负极,铝作正极;负极上失电子发生氧化反应,正极上得电子发生还原反应;
B、由Al、Mg与氢氧化钠溶液组成的原电池,该条件下,铝易失电子而作负极,镁作正极;
C、由Al、Mg、稀硫酸组成的原电池,镁活泼,所以镁作负极,电极反应式为:Mg-2e-=Mg2+;
D、由Fe、Cu、FeCl3组成的原电池,铁是负极,铜是正极,正极是铁离子放电.
解答 解:A、由Al、Cu与浓硝酸组成的原电池,该条件下,铜易失电子而作负极,铝作正极,负极上电极反应式为:Cu-2e-═Cu2+,故A正确;
B、由Al、Mg与氢氧化钠溶液组成的原电池,该条件下,铝易失电子而作负极,镁作正极,负极反应式为:Al-3e-+4OH-═AlO2-+2H2O,故B错误;
C、由Al、Mg、稀硫酸组成的原电池,镁活泼,所以镁作负极,电极反应式为:Mg-2e-=Mg2+,故C错误;
D、正极上铁离子得电子发生还原反应,电极反应式为:Fe 3++e-═Fe 2+,故D错误;
故选:A.
点评 本题考查了原电池正负极的判断,根据电极上得失电子来判断正负极,不能根据金属的活泼性强弱来确定正负极,为易错点.

练习册系列答案
相关题目
20.良好的生态环境可以提升生活质量.下列说法正确的是( )
| A. | 近年来雾霾天气越来越频繁,导致雾霾形成的主要污染物是PM2.5 | |
| B. | 垃圾分类既有利于保护生态环境,又能变废为宝,如图 为可回收物标志 为可回收物标志 | |
| C. | 选择环保的装修材料可以有效地减少居室污染,劣质合板释放出的主要污染物CO | |
| D. | 自来水有硬水和软水之分,含有钙、镁离子的水称之为硬水,不含有钙、镁离子的水称之为软水 |
17.除去括号内杂质所用试剂和方法不正确的是( )
| A. | KNO3(NaCl)--结晶 | B. | 水(酒精)--分液 | ||
| C. | Cu(Fe)--溶于足量盐酸,过滤 | D. | CO2(HCl)--饱和碳酸氢钠溶液,洗气 |
4.下列说法中,正确的是( )
| A. | 周期表中的各个主族都有非金属元素 | |
| B. | 周期表中的各个主族都有金属元素 | |
| C. | 周期表中的非金属元素都位于主族(除稀有气体) | |
| D. | 周期表中的非金属元素都位于短周期内 |
1.下列物质的分类合理的是( )
| A. | 碱:NaOH、KOH、Ba(OH)2、Na2CO3 | |
| B. | 氧化物:CO2、NO、SO2、H2O | |
| C. | 铵盐:NH4Cl、NH4NO3、(NH4)2SO4、NH3•H2O | |
| D. | 碱性氧化物:Na2O、CaO、Mn2O7、Al2O3 |
9.在下列条件下,两种气体的分子数一定相等的是( )
| A. | 同温度、同体积、同压强的O2与N2 | B. | 同质量、不同密度的N2和C2H4 | ||
| C. | 同体积、同密度的CO和 CH4 | D. | 同压强、同体积的N2和O2 |

 ;
; ,请写出B元素的单质与氢氧化钠溶液反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.
,请写出B元素的单质与氢氧化钠溶液反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.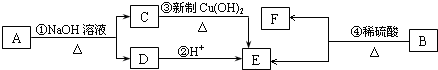
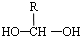 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$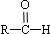 (R代表烃基).
(R代表烃基).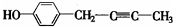 、
、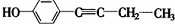 .
.