题目内容
【题目】Ⅰ.某工厂的工业废水中含有大量的FeSO4和较多的Fe3+和Cu2+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。实验室模拟该工业流程如图:
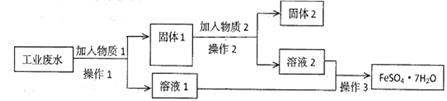
(1)检验废水中的Fe2+,实验室中用酸性KMnO4溶液检验,发生反应的离子方程式为________________________。
(2)加入过量物质1后,发生反应的离子方程式为___________________________。
(3)固体2是_____________________,实验室为长期保存硫酸亚铁溶液往往向其溶液中加入_______________________。
Ⅱ.工业上冶炼铝的原料是铝土矿(主要成分是Al2O3,杂质为Fe2O3、FeO、SiO2等)。某研究小组设计的提纯Al2O3的方案如下:

(1)加入过量的NaOH溶液,过滤后的滤液中含有的溶质有________(填化学式)。
(2)加入过量NaOH溶液过滤后,若滤渣中Fe(OH)2也被氧化,写出其被氧化的化学方程式__________________________。
(3)写出通入过量CO2生成沉淀A时反应的离子方程式为_________________________。
【答案】 5Fe2++MnO4-+8H+ = 5Fe3++Mn2++4H2O Fe+2Fe3+= 3Fe2+、Cu2++Fe=Cu+Fe2+ 铜(或Cu) 铁粉(或Fe) NaOH NaAlO2 NaCl 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 AlO![]() +CO2+2H2O===Al(OH)3↓+HCO
+CO2+2H2O===Al(OH)3↓+HCO![]()
【解析】试题分析:(1)Fe2+能被酸性高锰酸钾氧化为Fe3+;工业废水中含大量的FeSO4和较多的Fe3+和Cu2+,先加过量铁,过滤,得到溶液1为FeSO4,固体1为Cu和多余的铁,再向固体1中加过量稀硫酸,过滤得到的固体2为Cu,溶液2为FeSO4;
Ⅱ. 铝土矿中二氧化硅和盐酸不反应,滤液中含有氯化铝、氯化铁、氯化亚铁,加入过量的NaOH溶液,生成氢氧化铁、氢氧化亚铁沉淀和偏铝酸钠溶液,偏铝酸钠溶液中通入过量的二氧化碳可以生成氢氧化铝白色沉淀和碳酸氢钠, 滤渣中Fe(OH)2被氧气氧化为氢氧化铁。
解析:(1)Fe2+能被酸性高锰酸钾氧化为Fe3+,反应的离子方程式为5Fe2++MnO4-+8H+ = 5Fe3++Mn2++4H2O;(2)工业废水中含大量的FeSO4和较多的Fe3+和Cu2+,先加过量铁,铁粉与Fe3+和Cu2+都能反应,反应离子方程式是Fe+2Fe3+= 3Fe2+、Cu2++Fe=Cu+Fe2+;(3)固体1为Cu和Fe,再向Cu和Fe中加过量稀硫酸,Fe溶于硫酸,过滤得到的固体2为Cu;硫酸亚铁易被氧气氧化,向硫酸亚铁溶液中加入铁粉可以防止Fe2+被氧化。
Ⅱ. (1)铝土矿中二氧化硅和盐酸不反应,滤液中含有氯化铝、氯化铁、氯化亚铁,加入过量的NaOH溶液,生成氢氧化铁、氢氧化亚铁沉淀和偏铝酸钠溶液,所以过滤后的滤液中含有的溶质有NaAlO2 NaCl;(2)滤渣中Fe(OH)2被氧气氧化为氢氧化铁,被氧化的化学方程式4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3。
(3)偏铝酸钠溶液中通入过量的二氧化碳可以生成氢氧化铝白色沉淀和碳酸氢钠,反应的离子方程式为AlO![]() +CO2+2H2O===Al(OH)3↓+HCO
+CO2+2H2O===Al(OH)3↓+HCO![]() 。
。

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案