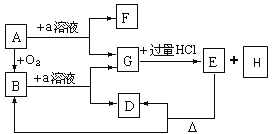
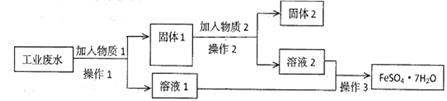
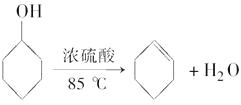
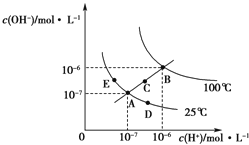
题目内容
【题目】(1)在标准状况下,将充满NO2的试管倒扣到盛水的水槽中,一段时间后,试管内气体的体积是试管体积的________________,假设试管内溶质不扩散,则试管内溶液中溶质的物质的量浓度为___________________。
(2)某铁的“氧化物”样品,用5mol/L的盐酸100mL恰好完全溶解,所得溶液还能吸收标准状况下1.12L氯气,使其中Fe2+恰好全部转化为Fe3+,发生反应的离子方程式为_________,该样品中Fe和O的个数比为_______________。
(3)向盛有10mL1mol/LNH4Al(SO4)2溶液的烧杯中滴加1mol/LNaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:(已知NH4++OH-=NH3·H2O)
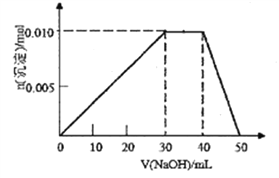
①写出滴加NaOH溶液40~50mL时反应的离子方程式:__________________。
②若10mL1mol/LNH4Al(SO4)2溶液中改加20mL1.15mol/LBa(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为_________________mol。
【答案】 1/3 1/22.4mol/L或0.045mol/L 2Fe2++Cl2=2Fe3++2Cl- 4:5 Al(OH)3+OH-=AlO2-+2H2O 0.024
【解析】试题分析:(1)根据![]() 分析;根据
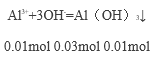
分析;根据![]() 计算试管内溶液中溶质的物质的量浓度;(2)Fe2+被氯气氧化为Fe3+,氯气被还有为Cl-;铁的“氧化物”中氧原子与盐酸中氢离子反应生成水,铁的“氧化物”中铁原子最终生成FeCl3,根据元素守恒计算Fe和O的个数比;(3)①滴加NaOH溶液40~50mL时沉淀溶解,是Al(OH)3与OH-反应生成AlO2- ;②10mL 1molL-1 NH4Al(SO4)2溶液中Al3+ 物质的量为0.01mol,NH4+的物质的量为0.01mol,SO42-的物质的量为0.02mol,20mL 1.15mol/L Ba(OH)2溶液中Ba2+物质的量为0.023mol,OH-为0.046mol,发生的反应有SO42-+Ba2+=BaSO4↓,根据图像可知OH-依次发生Al3++3OH-=Al(OH)3↓、 NH4++OH-=NH3H2O、 Al(OH)3+OH-=AlO2-+2H2O
计算试管内溶液中溶质的物质的量浓度;(2)Fe2+被氯气氧化为Fe3+,氯气被还有为Cl-;铁的“氧化物”中氧原子与盐酸中氢离子反应生成水,铁的“氧化物”中铁原子最终生成FeCl3,根据元素守恒计算Fe和O的个数比;(3)①滴加NaOH溶液40~50mL时沉淀溶解,是Al(OH)3与OH-反应生成AlO2- ;②10mL 1molL-1 NH4Al(SO4)2溶液中Al3+ 物质的量为0.01mol,NH4+的物质的量为0.01mol,SO42-的物质的量为0.02mol,20mL 1.15mol/L Ba(OH)2溶液中Ba2+物质的量为0.023mol,OH-为0.046mol,发生的反应有SO42-+Ba2+=BaSO4↓,根据图像可知OH-依次发生Al3++3OH-=Al(OH)3↓、 NH4++OH-=NH3H2O、 Al(OH)3+OH-=AlO2-+2H2O
解析:(1)根据![]() ,3体积的NO2与水反应后生成1体积的NO气体,所以试管内气体的体积是试管体积的
,3体积的NO2与水反应后生成1体积的NO气体,所以试管内气体的体积是试管体积的![]() ;设试管的体积是VL,则NO2的物质的量是
;设试管的体积是VL,则NO2的物质的量是![]() ,生成硝酸的物质的量是
,生成硝酸的物质的量是![]() ;试管中液体的体积是
;试管中液体的体积是![]() ,根据
,根据![]() ,试管内溶液中溶质的物质的量浓度是
,试管内溶液中溶质的物质的量浓度是 ;(2)Fe2+被氯气氧化为Fe3+,氯气被还有为Cl-,反应的离子方程式是2Fe2++Cl2=2Fe3++2Cl-;铁的“氧化物”中氧原子与盐酸中氢离子反应生成水,氢离子的物质的量是5mol/L×0.1L=0.5mol,所以氧原子的物质的量是0.25mol;铁的“氧化物”中铁原子最终生成FeCl3,氯元素的物质的量是
;(2)Fe2+被氯气氧化为Fe3+,氯气被还有为Cl-,反应的离子方程式是2Fe2++Cl2=2Fe3++2Cl-;铁的“氧化物”中氧原子与盐酸中氢离子反应生成水,氢离子的物质的量是5mol/L×0.1L=0.5mol,所以氧原子的物质的量是0.25mol;铁的“氧化物”中铁原子最终生成FeCl3,氯元素的物质的量是![]() ,所以铁原子的物质的量是0.2mol,根据元素守恒Fe和O的个数比0.2:0.25=4:5;(3)①滴加NaOH溶液40~50mL时沉淀溶解,是Al(OH)3与OH-反应生成AlO2- ,反应离子方程式是Al(OH)3+OH-=AlO2-+2H2O;②10mL 1molL-1 NH4Al(SO4)2溶液中Al3+ 物质的量为0.01mol,NH4+的物质的量为0.01mol,SO42-的物质的量为0.02mol,20mL 1.15 molL-1Ba(OH)2溶液中Ba2+物质的量为0.023mol,OH-为0.046mol,由SO42-+Ba2+=BaSO4↓,可知SO42-不足,故可以得到0.02mol BaSO4,
,所以铁原子的物质的量是0.2mol,根据元素守恒Fe和O的个数比0.2:0.25=4:5;(3)①滴加NaOH溶液40~50mL时沉淀溶解,是Al(OH)3与OH-反应生成AlO2- ,反应离子方程式是Al(OH)3+OH-=AlO2-+2H2O;②10mL 1molL-1 NH4Al(SO4)2溶液中Al3+ 物质的量为0.01mol,NH4+的物质的量为0.01mol,SO42-的物质的量为0.02mol,20mL 1.15 molL-1Ba(OH)2溶液中Ba2+物质的量为0.023mol,OH-为0.046mol,由SO42-+Ba2+=BaSO4↓,可知SO42-不足,故可以得到0.02mol BaSO4,
反应剩余OH-为0.046mol-0.03mol=0.016mol,![]()
反应剩余OH-为0.016mol-0.01mol=0.006mol,
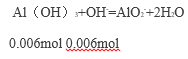
故得到Al(OH)3沉淀为0.01mol-0.006mol=0.004mol
则最终得到固体为0.02mol+0.004mol=0.024mol。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案【题目】化学与生产生活密切相关,下列物质的用途及解释均正确的是
选项 | 用途 | 解释 |
A | 可用FeCl3溶液刻蚀铜制电路板 | Fe3+的氧化性强于Cu2+ |
B | 碳与石英反应可冶炼粗硅 | 碳的非金属性比硅强 |
C | 四氯化碳可用于灭火 | 四氯化碳的沸点高 |
D | 酸性KMnO4溶 液可漂白织物 | KMnO4有强氧化性 |
A. A B. B C. C D. D
【题目】图中是实验室制备SO2并验证SO2某些性质的装置图。试回答:

(1)如果用浓硫酸和铜来制取SO2,发生装置还需选用的仪器是________,化学方程式为_________ 。
(2)⑤的作用是________,反应的离子方程式为________ 。
(3)选用图乙收集SO2气体,气体从________ 口 进。
(4)填表格
装置 | 实验现象 | 体现SO2的性质 |
① | ____________ | ____________ |
② | ____________ | ____________ |
③ | ____________ | ____________ |
④ | ____________ | ____________ |
【答案】 酒精灯 Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑ 吸收过量的SO2,防止污染环境 SO2+2OH- = SO32-+H2O b 溶液变红色 SO2水溶液显酸性 溶液褪色 漂白性 溶液变浑浊 氧化性 氯水褪色 还原性
CuSO4+2H2O+SO2↑ 吸收过量的SO2,防止污染环境 SO2+2OH- = SO32-+H2O b 溶液变红色 SO2水溶液显酸性 溶液褪色 漂白性 溶液变浑浊 氧化性 氯水褪色 还原性
【解析】(1)利用铜和浓硫酸制取SO2,选择固体与液体反应且需加热装置,故发生装置还需选用的仪器是酒精灯;Cu与浓硫酸反应生成硫酸铜、二氧化硫和水,反应为Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑;(2)⑤中的作用是吸收二氧化硫,防止二氧化硫污染环境,发生的离子反应为:SO2+2OH- = SO32-+H2O;(3)SO2易溶于水,密度比空气大,选用图乙收集SO2气体,气体从b口进;(4)①二氧化硫与水反应生成亚硫酸,遇石蕊变红,则实验现象变红,说明二氧化硫为酸性气体;因二氧化硫具有漂白性,则②中的品红溶液褪色;
CuSO4+2H2O+SO2↑;(2)⑤中的作用是吸收二氧化硫,防止二氧化硫污染环境,发生的离子反应为:SO2+2OH- = SO32-+H2O;(3)SO2易溶于水,密度比空气大,选用图乙收集SO2气体,气体从b口进;(4)①二氧化硫与水反应生成亚硫酸,遇石蕊变红,则实验现象变红,说明二氧化硫为酸性气体;因二氧化硫具有漂白性,则②中的品红溶液褪色;
③中二氧化硫与硫化氢发生氧化还原反应生成单质S,该反应为SO2+2H2S═3S↓+2H2O,实验现象为淡黄色沉淀生成,二氧化硫中S元素的化合价降低,则二氧化硫具有氧化性;
④中二氧化硫与氯水发生氧化还原反应生成硫酸和HCl,该反应为:SO2+Cl2+2H2O═2HCl+H2SO4,实验现象为氯水褪色,二氧化硫中S元素的化合价升高被氧化,说明二氧化硫具有还原性,故答案为:
装置 | 实验现象 | 体现SO2的性质 |
① | 溶液变红色 | 二氧化硫水溶液显酸性 |
② | 溶液褪色 | 漂白性 |
③ | 溶液变浑浊 | 氧化性 |
④ | 氯水褪色 | 还原性 |
点睛:本题考查物质制备实验及性质实验,主要考查了二氧化硫的化学性质及检验方法,明确各装置的作用及发生的化学反应是解答本题的关键,注意掌握二氧化硫的性质及检验方法。综合性较强的为(4)①中二氧化硫与水反应生成亚硫酸,遇石蕊变红;②中品红溶液褪色;③中二氧化硫与硫化氢发生氧化还原反应生成单质S;④中二氧化硫与氯水发生氧化还原反应生成硫酸和HCl,据此进行解答。
【题型】实验题
【结束】
28
【题目】某课外小组准备在实验室配制95mL1.0mol/L的硝酸溶液,然后再研究金属铜与硝酸的反应情况。
(1)配制95mL1.0mol/L的硝酸溶液,需要的仪器除烧杯、玻璃棒、量筒、胶头滴管外,还需要的玻璃仪器是_____________。
(2)若用10mol/L的浓硝酸来配制上述溶液,需要量取浓硝酸的体积是_________mL。
(3)配制过程中,下列操作会引起浓度偏小的是________。
A,.定容摇勾后发现液面低于刻度线,再加水至刻度线
B.定容时俯视容量瓶的刻度线
C.将溶液转入容量瓶后,没有洗涤烧杯和玻璃棒,就进行定容操作
D.容量瓶用蒸馏水洗涤后未烘干
E.量取浓硝酸后,用少量蒸馏水洗涤量筒并将洗涤液也放入烧杯
(4)课外小组同学将制得的硝酸与铜片在下列装置中反应,反应初期观察到大试管中的液体a逐渐变为蓝色,试管上方有浅红棕色气体出现。
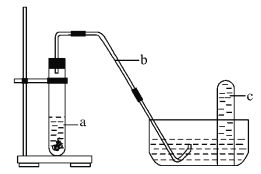
①反应初期液体a逐渐变为蓝色是由于反应生成了_________(填化学式)。
②请解释反应初期试管上方有浅红棕色气体出现的理由_________ (结合化学方程式说明)。
③导致红棕色气体在试管c中颜色消失的反应方程式为_________。