题目内容
【题目】下列说法中正确的是( )
A. 用砂纸打磨过的铝箔在空气中加热,会熔化并剧烈燃烧
B. 向盛水的烧杯中投入一大块钠,这样现象更明显
C. 铁在纯氧中点燃,会剧烈燃烧,火星四射,生成氧化二铁
D. 铝制容器不可以用来长期存放酸性,碱性或咸的食物
【答案】D
【解析】A、用砂纸打磨过的铝箔在空气中加热,会熔化但不滴落,但不会剧烈燃烧,故A错误;B、向盛水的烧杯中投入一大块钠,这样反应太剧烈,不安全,同时又造成浪费,故B错误;C、铁在纯氧中点燃,会剧烈燃烧,火星四射,生成四氧化三铁,故C错误;D、铝具有两性,既可与酸反应,又可能与碱反应,铝制容器不可以用来长期存放酸性,碱性或咸的食物,故D正确;故选D。

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
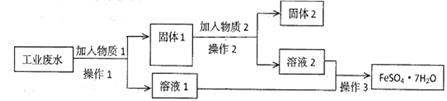
名校名卷单元同步训练测试题系列答案【题目】绿矾(FeSO4·7H2O)、硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]是重要的化学化工试剂。工业上常利用机械加工行业产生的废铁屑为原料制备。
请回答下列问题:
(1)下图所示装置用于制备绿矾。其中锥形瓶中盛放的药品或原料是 , 集气瓶的作用是;烧杯中主要发生:①CuSO4+H2S=CuS↓+H2SO4 , ②4CuSO4+PH3+4H2O=H3PO4+4H2SO4+4Cu,则烧杯中盛放的试剂是 , 其作用是。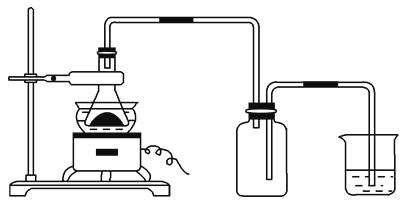
(2)下图所示装置用于制备硫酸亚铁铵。在0~60 ℃的温度范围内,硫酸亚铁铵在水中的溶解度比硫酸铵、硫酸亚铁的溶解度小,冷却混合液至室温便析出硫酸亚铁铵。具体操作:①打开活塞 , 关闭活塞 , 从分液漏斗滴入6 mol·L-1H2SO4到250 mL锥形瓶,充分反应。②待锥形瓶中的铁屑快反应完时,关闭活塞 , 打开活塞。③放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵。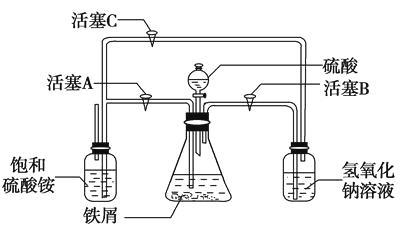
(3)在制备硫酸亚铁的过程中,理论上控制铁过量或酸过量均有利于防止Fe2+被氧化。设计两个实验:实验一,控制酸过量;实验二,控制铁过量;其余步骤相同,制得硫酸亚铁铵,并对产品质量进行检测。检测结果如下:
序号 | 反应物用量 | 产品质量 |
1 | n(H2SO4)∶n(Fe)>1∶1 | 介于Ⅰ级~Ⅱ级之间 |
2 | n(H2SO4)∶n(Fe)<1∶1 | 优于Ⅰ级 |
已知产品质量标准:Fe3+的质量分数等于0.005%,产品质量定为Ⅰ级;Fe3+的质量分数等于0.01%,产品质量定为Ⅱ级,从实验结果中,可得出制备硫酸亚铁溶液时,反应控制过量为最佳。