题目内容
【题目】将下图所列仪器组装为一套实验室蒸馏石油的装置,并进行蒸馏,得到汽油和煤油。
(三) | (一) | (五) |
|
|
|
(二) | (六) | (四) |
|
|
|
(1)图中A、B、C三种仪器的名称分别是。
(2)将以上仪器按(一)~(六)顺序,用字母a,b,c…表示连接顺序:
e接;接;接;接;接。
(3)A仪器中c口是 , d口是(填“进水口”或“出水口”)。
(4)蒸馏时,温度计水银球应在位置。
(5)在B中注入原油后,加几片碎瓷片的目的是。
(6)给B加热,收集到沸点60~150℃间的馏分是 , 收集到150~300℃间的馏分是。
【答案】
(1)A是冷凝管,B是蒸馏烧瓶,C是锥形瓶
(2)i;h;a;k;l;b;f;g;w
(3)进水口;出水口
(4)蒸馏烧瓶支管口
(5)防止暴沸
(6)汽油;煤油
【解析】石油的蒸馏按沸点范围不同分离出汽油和煤油,必须用温度计控制温度,然后冷凝收集。实验应注意以下几点:①温度计水银球的位置应位于蒸馏烧瓶支管口处,因为测的是馏分蒸气的沸点温度;②冷凝管内的冷却水要从下口进、从上口出,这样冷却效果好。③碎瓷片的作用:防止混合液剧烈跳动(暴沸)。
【考点精析】本题主要考查了蒸馏与分馏的相关知识点,需要掌握蒸馏是将液态物质加热到沸腾变为蒸气,又将蒸气冷却为液体这两个过程联合操作.用这一操作可分离、除杂、提纯物质;分馏和蒸馏一样,也是利用混合物中各物质的沸点不同,严格控制温度,进行分离或提纯物质的操作,是多次的蒸馏才能正确解答此题.

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
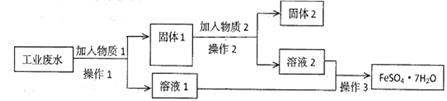
学练快车道口算心算速算天天练系列答案【题目】绿矾(FeSO4·7H2O)、硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]是重要的化学化工试剂。工业上常利用机械加工行业产生的废铁屑为原料制备。
请回答下列问题:
(1)下图所示装置用于制备绿矾。其中锥形瓶中盛放的药品或原料是 , 集气瓶的作用是;烧杯中主要发生:①CuSO4+H2S=CuS↓+H2SO4 , ②4CuSO4+PH3+4H2O=H3PO4+4H2SO4+4Cu,则烧杯中盛放的试剂是 , 其作用是。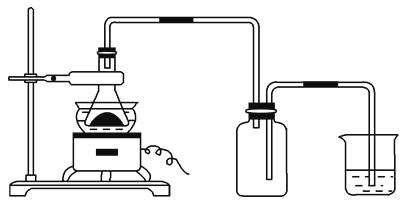
(2)下图所示装置用于制备硫酸亚铁铵。在0~60 ℃的温度范围内,硫酸亚铁铵在水中的溶解度比硫酸铵、硫酸亚铁的溶解度小,冷却混合液至室温便析出硫酸亚铁铵。具体操作:①打开活塞 , 关闭活塞 , 从分液漏斗滴入6 mol·L-1H2SO4到250 mL锥形瓶,充分反应。②待锥形瓶中的铁屑快反应完时,关闭活塞 , 打开活塞。③放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵。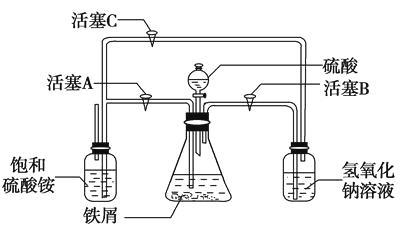
(3)在制备硫酸亚铁的过程中,理论上控制铁过量或酸过量均有利于防止Fe2+被氧化。设计两个实验:实验一,控制酸过量;实验二,控制铁过量;其余步骤相同,制得硫酸亚铁铵,并对产品质量进行检测。检测结果如下:
序号 | 反应物用量 | 产品质量 |
1 | n(H2SO4)∶n(Fe)>1∶1 | 介于Ⅰ级~Ⅱ级之间 |
2 | n(H2SO4)∶n(Fe)<1∶1 | 优于Ⅰ级 |
已知产品质量标准:Fe3+的质量分数等于0.005%,产品质量定为Ⅰ级;Fe3+的质量分数等于0.01%,产品质量定为Ⅱ级,从实验结果中,可得出制备硫酸亚铁溶液时,反应控制过量为最佳。
【题目】图中是实验室制备SO2并验证SO2某些性质的装置图。试回答:

(1)如果用浓硫酸和铜来制取SO2,发生装置还需选用的仪器是________,化学方程式为_________ 。
(2)⑤的作用是________,反应的离子方程式为________ 。
(3)选用图乙收集SO2气体,气体从________ 口 进。
(4)填表格
装置 | 实验现象 | 体现SO2的性质 |
① | ____________ | ____________ |
② | ____________ | ____________ |
③ | ____________ | ____________ |
④ | ____________ | ____________ |
【答案】 酒精灯 Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑ 吸收过量的SO2,防止污染环境 SO2+2OH- = SO32-+H2O b 溶液变红色 SO2水溶液显酸性 溶液褪色 漂白性 溶液变浑浊 氧化性 氯水褪色 还原性
CuSO4+2H2O+SO2↑ 吸收过量的SO2,防止污染环境 SO2+2OH- = SO32-+H2O b 溶液变红色 SO2水溶液显酸性 溶液褪色 漂白性 溶液变浑浊 氧化性 氯水褪色 还原性
【解析】(1)利用铜和浓硫酸制取SO2,选择固体与液体反应且需加热装置,故发生装置还需选用的仪器是酒精灯;Cu与浓硫酸反应生成硫酸铜、二氧化硫和水,反应为Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑;(2)⑤中的作用是吸收二氧化硫,防止二氧化硫污染环境,发生的离子反应为:SO2+2OH- = SO32-+H2O;(3)SO2易溶于水,密度比空气大,选用图乙收集SO2气体,气体从b口进;(4)①二氧化硫与水反应生成亚硫酸,遇石蕊变红,则实验现象变红,说明二氧化硫为酸性气体;因二氧化硫具有漂白性,则②中的品红溶液褪色;
CuSO4+2H2O+SO2↑;(2)⑤中的作用是吸收二氧化硫,防止二氧化硫污染环境,发生的离子反应为:SO2+2OH- = SO32-+H2O;(3)SO2易溶于水,密度比空气大,选用图乙收集SO2气体,气体从b口进;(4)①二氧化硫与水反应生成亚硫酸,遇石蕊变红,则实验现象变红,说明二氧化硫为酸性气体;因二氧化硫具有漂白性,则②中的品红溶液褪色;
③中二氧化硫与硫化氢发生氧化还原反应生成单质S,该反应为SO2+2H2S═3S↓+2H2O,实验现象为淡黄色沉淀生成,二氧化硫中S元素的化合价降低,则二氧化硫具有氧化性;
④中二氧化硫与氯水发生氧化还原反应生成硫酸和HCl,该反应为:SO2+Cl2+2H2O═2HCl+H2SO4,实验现象为氯水褪色,二氧化硫中S元素的化合价升高被氧化,说明二氧化硫具有还原性,故答案为:
装置 | 实验现象 | 体现SO2的性质 |
① | 溶液变红色 | 二氧化硫水溶液显酸性 |
② | 溶液褪色 | 漂白性 |
③ | 溶液变浑浊 | 氧化性 |
④ | 氯水褪色 | 还原性 |
点睛:本题考查物质制备实验及性质实验,主要考查了二氧化硫的化学性质及检验方法,明确各装置的作用及发生的化学反应是解答本题的关键,注意掌握二氧化硫的性质及检验方法。综合性较强的为(4)①中二氧化硫与水反应生成亚硫酸,遇石蕊变红;②中品红溶液褪色;③中二氧化硫与硫化氢发生氧化还原反应生成单质S;④中二氧化硫与氯水发生氧化还原反应生成硫酸和HCl,据此进行解答。
【题型】实验题
【结束】
28
【题目】某课外小组准备在实验室配制95mL1.0mol/L的硝酸溶液,然后再研究金属铜与硝酸的反应情况。
(1)配制95mL1.0mol/L的硝酸溶液,需要的仪器除烧杯、玻璃棒、量筒、胶头滴管外,还需要的玻璃仪器是_____________。
(2)若用10mol/L的浓硝酸来配制上述溶液,需要量取浓硝酸的体积是_________mL。
(3)配制过程中,下列操作会引起浓度偏小的是________。
A,.定容摇勾后发现液面低于刻度线,再加水至刻度线
B.定容时俯视容量瓶的刻度线
C.将溶液转入容量瓶后,没有洗涤烧杯和玻璃棒,就进行定容操作
D.容量瓶用蒸馏水洗涤后未烘干
E.量取浓硝酸后,用少量蒸馏水洗涤量筒并将洗涤液也放入烧杯
(4)课外小组同学将制得的硝酸与铜片在下列装置中反应,反应初期观察到大试管中的液体a逐渐变为蓝色,试管上方有浅红棕色气体出现。
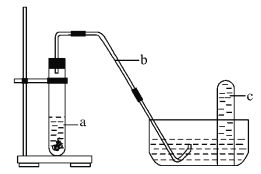
①反应初期液体a逐渐变为蓝色是由于反应生成了_________(填化学式)。
②请解释反应初期试管上方有浅红棕色气体出现的理由_________ (结合化学方程式说明)。
③导致红棕色气体在试管c中颜色消失的反应方程式为_________。