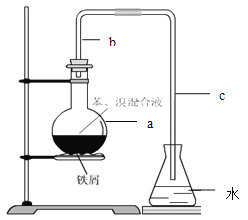
题目内容
【题目】某化学兴趣小组设计如下流程,从酸性工业废液(含H+、Al3+、Mg2+、Cr3+、SO42)中提取铬.
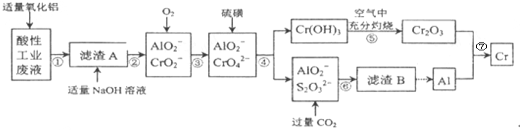
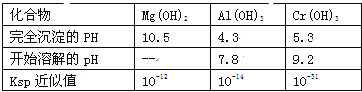
有关数据如表:
回答下列问题:
(1)步骤①所得滤液可用于制取MgSO47H2O,酸性工业废液中加入适量氧化铝的作用是____。
(2)若酸性废液中c(Mg2+)=0.1mol/L,为达到步骤①的实验目的,则废液的pH应保持在_______范围(保留小数点后l位)。当溶液Ph=5时,c(Cr3+)=__________
(3)步骤②中生成NaCrO2 的离子方程式为_____________。
(4)步骤④中反应的离子方程式为________________。
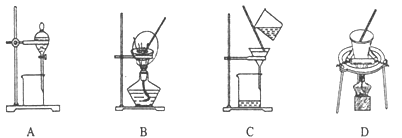
(5)步骤⑤在空气中充分灼烧的目的是__________________,可选用的装置是________。(填序号)
(6)步骤⑦发生的化学反应方程式为____________________________。
【答案】
(1)调节溶液的pH;
(2)5.3<pH<7.8,10-4mol/L;
(3)Cr(OH)3+OH-=CrO2-+2H2O;
(4)7H2O+4CrO42-+6S=4Cr(OH)3↓+3S2O32-+2OH-;
(5)使Cr(OH)3完全转化为Cr2O3, D;
(6)2Al+ Cr2 O3![]() Al2O3+2Cr
Al2O3+2Cr
【解析】
试题分析:(1)从酸性工业废液(含H+、Al3+、Mg2+、Cr3+、SO42)中提取铬,步骤①所得滤液可用于制取MgSO47H2O,向滤液中加入氧化铝的作用是调节溶液的pH,得到滤渣为氢氧化铝和氢氧化铬,滤液中主要是硫酸镁溶液,滤渣A中加入过量的氢氧化钠得到CrO2-、AlO2-溶液,加入氧气将CrO2-氧化为CrO4-,再加入硫磺,过滤得到氢氧化铬。(1)酸性工业废水中加入适量的氧化铝的作用是调节溶液的pH,得到氢氧化铝和氢氧化铬,答案为:调节溶液的pH;(2)步骤①的实验目的是得到氢氧化铝和氢氧化铬,根据表中的数据可知废液的pH应保持在5.3~7.8,当溶液的pH为5时,c(OH-)=10-9,经计算得c(Cr3+)=10-4mol/L,答案为:5.3<pH<7.8,10-4mol/L;(3)步骤②中生成NaCrO2 的离子方程式为Cr(OH)3+OH-=CrO2-+2H2O,答案为:Cr(OH)3+OH-=CrO2-+2H2O;(4)步骤④加硫磺得到铬酸根,反应的离子方程式为:7H2O+4CrO42-+6S=4Cr(OH)3↓+3S2O32-+2OH-,答案为:7H2O+4CrO42-+6S=4Cr(OH)3↓+3S2O32-+2OH-;(5)步骤⑤在空气中充分灼烧的目的是为将氢氧化铬分解得到氧化铬,应该用到坩埚,答案为:使Cr(OH)3完全转化为Cr2O3,D;(6)步骤⑦是Al将三氧化二铬中的铬置换出来,即铝热反应,答案为:2Al+ Cr2 O3![]() Al2O3+2Cr.
Al2O3+2Cr.